实验是化学研究的一种重要手段,现有下图所示A~G七种仪器,请根据要求填空。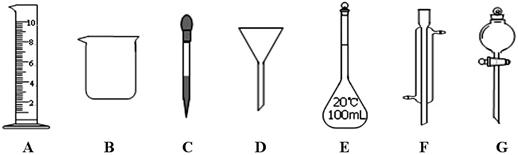
(1)写出仪器名称:B ,F
(2)下列实验操作中用到仪器G的是 (选填下列选项的编号字母)。
a.分离水和CC14的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
(3)实验室配制100mL 0.5mol/L的盐酸溶液。
①下列关于仪器E的使用方法中,正确的是 (选填下列选项的编号字母)。
a.使用前应检查是否漏液 b.使用前必须烘干
c.不能用作物质反应或溶解的容器 d.热溶液可直接转移到容量瓶中
②需10mol/L的浓盐酸 mL。取用该体积盐酸时,需要用到上述仪器中的A和
(选填仪器的编号字母)。
③在实验时,按下列步骤“计算→量取→溶解→转移→定容→保存到试剂瓶中”进行配制,定容后,液面位置(如下左图)正确的是 (选填下列选项的编号字母)。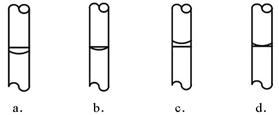
④请在试剂瓶标签上填写相应内容(盛放上述配制好的溶液)[(标签如上右图)]。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯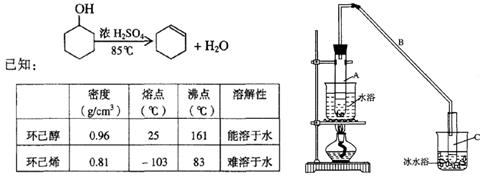
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是,导管B除了导气外还具有的作用是。
②试管C置于冰水浴中的目的是。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在层(填上或下),分液后用_________(填入编号,单选)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3 溶液
溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入,目的是_____________________________。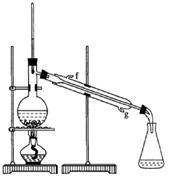
③收集产品时,控制的温度应在_________左右 ,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
,实验制得的环己烯精品质量低于理论产量,可能的原因是(单选)
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和PCl5遇水强烈反应,它们熔沸点数据如下: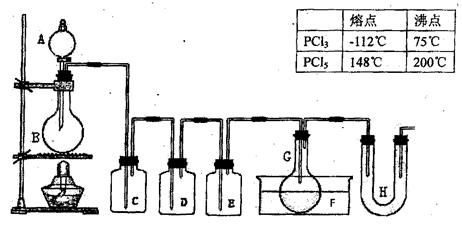
请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是。
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,发生反应的化学方程式为。
,发生反应的化学方程式为。
(3)若发现C中气泡产生过猛,需要进行的操作的关键是。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是;从PCl3和PCl5的混合物中分离也PCl3的最佳方法是(选填序号)。
a.蒸馏 b.分液 c.升华
(5)生成的PCl3在G中收集,则F中盛有,作用是
(6)C、D、H所盛的试剂分别是:C;D ;H。
;H。
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因 是。
是。
(1)写出实验室由苯和浓硝酸反应制取硝基苯的化学方程式:.
该反应属于反应。
(2)如图所示的实验装置图中存在哪些错误?请指正。
①;
②;
③。
(3)在试管中将两种浓酸混和的操作方法是
(4)试简述水浴加热的优点。
某学生用0.1 mol/L的KOH标准溶液滴定未知浓度盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至0刻度以上2-3 cm |
E.调节液面至0或0以下刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空
(1)正确操作步骤的顺序是(用序号字母填写)____________________________;
(2)上述B步骤操作的目的是________________________________________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是________;
(4)判断到达滴定终点的实验现象是_____________________________________;
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸则对滴定结果产生的影响是____________________________________。
 某探究
某探究 小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
小组同学用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速率的因素。
实验药品:2. 0moL/L 盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属
盐酸、4. 0mol/L盐酸、2 .0mol/L硫酸、4.0mol/L硫酸,质量和相同的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50. 0mL,金属 用量均为9. 0g。
用量均为9. 0g。
(Ⅰ)甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
| 4.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
反应结束 |
| 2.0mol/L硫酸 |
无明显现象 |
极少量气泡 |
少量气泡 |
||
| 4.0mol/L硫酸 |
无明显现象 |
少量气泡 |
有比 较连续的气泡 较连续的气泡 |
请回答:
(1)写出铝与盐酸反应的离子方程式。
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)以上探究铝与稀盐酸、稀硫酸反应速率有差异,你认为其原因有哪些可能?请提出 你的假设(写出2种可能):。
你的假设(写出2种可能):。
(Ⅱ)(1)乙同学设计了如下影响反应速率因素的实验(温度控制为25℃和35℃)。请你根据实验目的帮助该同学完成以下实验设计表(用量:酸均为50. 0mL、铝为9. 0g过量):
| 实验目的 |
实验 编号 |
温度 |
金属铝 形态 |
盐酸浓度 /mol·L-1 |
| 1. 实验①和②探究盐酸浓度对该反应速率的影响; 2. 实验①和③探究温度对该反应速率的影响; 3. 实验①和④探究金属规格(铝片、铝粉)对该反应速率的影响。 |
① |
25˚ C C |
铝 |
4. 0 |
| ② |
||||
| ③ |
||||
| ④ |