常温下,如果取0.1mol·L-1HA溶液与0.1mol···L-1NaOH溶液等体积混合(不计混合后溶液体积的变化),测得混合液的pH=8,请回答下列问题:
(1)混合后溶液的pH=8的原因(用离子方程式表示): 。
(2)混合溶液中由水电离出的c(H+) (填<、>、=)0.1mol·L-1NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
C(Na+) -c(A-)= mol·L-1,c(OH-)-c(HA)= mol·L-1。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);将同温下等物质的量浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2CO3 D.NH4Cl
按pH由大到小的顺序排列: (填序号)。
工业上根据污水中所含物质或离子的不同,有多种处理方法,比如: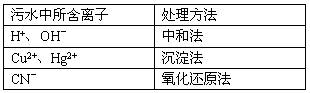
请回答:
(1)在中和法中,若用CO2来处理污水,则离子方程式是___________________________。
(2)在沉淀法中,用硫化钠作沉淀剂,能有效地处理含Cu2+、Hg2+等重金属离子的污水。若某污水中能与硫化钠反应的阳离子只有Hg2+,且含量为400mg/L,则处理10L这样的污水至少需要加入硫化钠________g(精确到0.1)
我国规定的排放标准不能超过0.05mg/L,若1L污水经过沉淀法处理后含Hg2+为2×10-7 mol,则该污水是否达到了排放标准_____________(填“是”或“否”)
(3)在氧化还原法中,常用Cl2氧化污水中有毒的CN-,得到元素的CO2和N2,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式是__________________________________。
R、Q、X、Y、Z均为短周期元素,且原子序数依次增大。已知Q元素在自然界中组成的化合物种类最多;Y原子最外层电子数与核外电子数之比为 3:4 ;R与Y、Z与Y均可组成原子个数比为1:1和2:1的两种化合物。据此回答:
(1)由R、X、Y三种元素可组成多种化合物,写出两种常见的不同类型的化合物的化学式
___________、______________。
(2)在Q和X组成化合物(QX)2中,Q、X原子均满足最外层8电子结构,则的电子式是(QX)2______。
(3)已知R与Q可组成化合物甲,R与Y可组成化合物乙,其中一个甲分子有10个电子,而一个乙分子有18个电子。
①甲的结构式是_____________。乙分子中共价键数是_____________。
②甲是一种重要的能源,通常状况下,1mol 甲在空气中完全燃烧生成二氧化碳和水,放出890kJ的热,若此时燃烧40g的甲,产生的热量是________kJ。
③在酸性条件下,向FeI2的淀粉溶液中加入乙,溶液变蓝。当1 mol Fe2+被氧化成Fe3+时,反应中电子转移为4 mol,该反应的离子方程式是_____________________________________________。
(10分)海水中化学资源的综合开发利用已受到各国的高度重视。Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的步骤: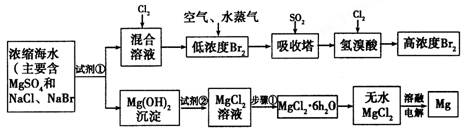
请回答:
I.从海水中提取的溴占世界年产量的1/3,主要方法就是上述流程中的空气吹出法。
(1)制取Br2时,第一次通入Cl2发生反应的离子方程式是__________________。
(2)吸收塔中反应的离子方程式是________________________________________。
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是
__________________。(用“”表示)
II.镁及其合金是用途很广泛的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的。
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用___________(写化学式)。
(2)加入试剂②后反应泊离子方程式是_________________________________。
(3)步骤①包括加热、蒸发、冷却、结晶、_________。
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是
___________________________________________________。
III.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸。生产方法是:
①将氯化镁晶体(MgCl2·6H2O)加热到523OC以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体。
②将两种气体冷却到室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸。
(1)MgCl2·6H2O在523OC以上分解的化学方程式是_____________________________。
(2)现用1mol MgCl2·6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水__________g(精确到0.1),该盐酸中溶质的物质的量浓度是____________mol/L(精确到0.1)。
I.有机玻璃是一种高分子化合物,在工业和生活中有着广泛用途,工业上可通过下列合成方法制得:
请回答:
(1)反应①的原子利用率是___________。
(2)反应②的化学方程式是____________________________________,
该反应的反应类型是_____________________。
(3)有机玻璃分子中的链节是____________________________。
II.甲基丙烯酸甲酯旧法合成的反应是:
①
②
(1)该方法的缺点是___________________________(填字母)
A.反应的原料利用率低 B.原料中有有毒物质
C.对设备腐蚀性较大 D.生产成本高
(2)甲基丙烯酸甲酯可进行的反应有______________(填字母)
A.加成反应 B.氧化反应 C.取代反应 D酯化反应.
(3分)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,回答下列问题:
(1)该反应在______min时达到化学平衡状态。
(2)该反应的化学方程式是_______________________________。
(3)从开始到2 min ,Z的平均反应速率是_________________________。