现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 |
H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 |
OH—、C1—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同)。
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀。
试回答下列问题:
(1)分别写出下列物质的化学式:A 、B 、E ;
(2)写出A、E反应的离子方程式: ;
(3)将C溶液逐滴加入等体积、等物质的量浓度的A溶液中,反应后溶液中各种离子浓度由大到小的顺序为: 。
(4)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H =-Q kJ·mol-1。
写出B与C稀溶液反应的热化学方程式 。
(5)在100 mL 0.1 mol·L-1 E溶液中,逐滴加入40 mL 1.6 mol·L-1 NaOH溶液,最终得到沉淀物质的量为
mol。
(Ⅰ)将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑。再在酒精灯上将该铜丝加热至红热状态。 如右图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟。冷却后取出铜丝,可看到铜丝变成光亮的紫红色。回答下列问题: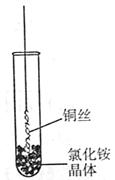
⑴解释“当红热的铜丝插入氯化铵晶体中,出现白烟”的原因(用化学方程式表示)。
⑵灼热的氧化铜在氯化铵中变成单质铜,写出该反应的化学方程式
。
( II)2008年,我国的航天事业取得了巨大的成就,航天员翟志刚顺利实现了太空行走。在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴N2H4·H2O能发生类似NH3·H2O的微弱电离,使溶液显示弱碱性,该电离分两步,写出第一步电离的方程式。
⑵在实验室中,用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是(填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.冷凝管 |
E.牛角管(接液管) F.蒸馏烧瓶 G.酸式滴定管
②除上述必需的仪器外,还缺少的玻璃仪器是。
⑶肼能使锅炉内壁的铁锈(主要成分Fe2O3)变成磁性氧化铁(Fe3O4)层,可减缓锅炉锈蚀。若反应过程中肼转化为氮气,每生成1molFe3O4,需要消耗肼的质量为g。
A、B、C是由周期表中短周期元素间组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如下的反应关系: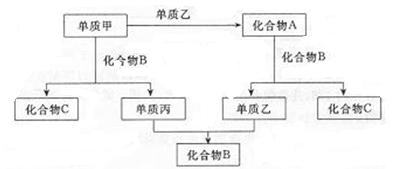
据此推断:
⑴ 在A、B、C这三种化合物中,必定含有的元素是(用字母甲、乙、丙表示)。
⑵ 单质甲必定是(金属或非金属),并写出单质甲和化合物B反应生成单质丙和化合物C的化学方程式。
⑶ 单质乙的化学式是,化合物A的电子式为。
在有机化学工业中常用的一种钠盐是NaBH4,即硼氢化钠。它具有很强的还原性,也是一种高贮氢密度材料,是最有可能作为氢燃料电池的即时供应氢源。但它不能与水和酸共存。
⑴将其投入水中可生成偏硼酸钠(NaBO2)和氢气,写出该反应的化学方程式,反应中的还原剂是,每摩NaBH4反应时电子转移数为mol。
⑵若将NaBH4投入酸溶液中其反应速率与其放入水中相比,应快还是慢,理由是。
⑶NaBH4还用于将含Au3+的碱性废液中回收黄金,其离子方程式为: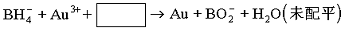
请写出配平的离子方程式。
过氧化氢(H2O2)是一种无色粘稠液体,其水溶液又俗称双氧水,呈弱酸性,医疗上用作外科消毒剂。研究表明:H2O2具有立体结构,两个氢原子像在半展开书本的两页纸上,两页纸面的夹角约为94°,氧原子在书的夹缝上,O-H键与O-O键之间的空间夹角约为97°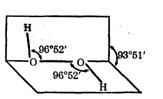
⑴H2O2的电子式为,其分子属于(填:“极性”或“非极性”)分子。
⑵经测定,H2O2为二元弱酸,其酸性比碳酸弱,请写出其第一步的电离方程式_____________。
⑶H2O2溶液与一种弱酸的酸性氧化物反应生成强酸,该反应的离子方程式为,
并在方程式上标出电子转移的方向与数目。
⑷为了贮存、运输、使用的方便,工业上采用“醇析法”将其转化为固态的过碳酸钠晶体(其化学式为2Na2CO3·3H2O2),该晶体具有Na2CO3和H2O2的双重性质。则下列物质能使过碳酸钠较快失效的是(多选)。
| A.MnO2 | B.H2S | C.稀H2SO4 | D.NaHCO3 |
完成下列各小题中的化学反应方程式。
⑴碱金属与O2反应生成氧化物较复杂,有普通氧化物(如Na2O)过氧化物(如Na2O2)还有超氧化物和臭氧化物等。因此要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。试用化学方程式表示以下反应:①钠与过氧化钠反应。
②钾还原硝酸钾还产生了一种单质气体。
⑵铝能从许多氧化物中夺取氧,利用铝的亲氧性除用于冶炼难熔金属外,还用于制取耐高温的金属陶瓷。例如将铝粉、石墨和二氧化钛按一定比例混和均匀,浮在金属表面上,然后在高温下煅烧,生成耐热的TiC,写出该反应的化学方程式。
⑶将Al(OH)3和Na2CO3的混和物一同溶于氢氟酸可制得电解法炼铝必需的熔剂冰晶石(Na3AlF6),同时反应中产生一种无色无味的气体,试写出有关化学方程式_________________。