X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应:
Y+X→甲(g),Y+Z→乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是 。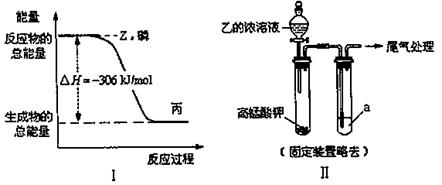
(2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是8电子结构,丙的电子式是 。磷单质和Z单质反应生成1mol丙时,反应过程与能量变化如图I所示,该反应的热化学方程式是 。
(3)某同学拟用图II所示证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是 的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是
(4)向一定浓度的BaC12溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由甲和乙中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是 、 。
现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中 的比值将__________(填“增大”、“减小”或“无法确定”)。
的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙)(填“大于”、“小于”或“等于”)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。(填“大于”、“小于”或“等于”)。
(4)室温下,现有pH=2的醋酸溶液与PH=12的氨水,等体积混合后,溶液呈中性,则溶液中离子浓度的大小关系:_______。
在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g); =-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
(1)该温度下此反应反应物的总键能和 (填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率 (H2)为 。
(H2)为 。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.Q1+Q2=aB.α3<α1
C.P3<2P1=2P2D.n2<n3<1.0mol
(6)已知:①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g)△H= -41 kJ·mol-l
CO2(g)+H2(g)△H= -41 kJ·mol-l
2H2(g)+CO(g) CH3OH(g);
CH3OH(g); =-a KJ·mol-1,则a=
=-a KJ·mol-1,则a=
恒容体系,发生如下反应2A(g) B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
B(g)+xC(?) △H,起始时B、C物质的量浓度为0,A的物质的量浓度随时间变化如下图(某课外活动小组一共进行了如图所示的三个实验,其中T1、T2表示不同的反应温度):
(1)在实验Ⅲ中,0~20min的时间内,v(B)= 。
(2)根据以上实验事实,完成以下填空:x= ,生成物C的状态为 ,反应热
△H 0(填“>”、“=”或者“<”)。
(3)在实验Ⅱ中,当化学反应进行到35min时,下列关于反应体系中的有关说法,正确的是 。
a.单位时间内生成n mol B的同时生成2n mol A
b.单位时间内生成n mol C的同时消耗2n mol A
c.用A、B、C表示的反应速率的比为2:1:2
d.混合气体中反应物A与生成物B的体积分数之比为2:1
e.混合气体中B与C的物质的量相等
(4)该反应的化学平衡常数表达式K= ,在T2℃时K的数值为 。
(5)T1℃时,保持容器的体积不变,若充入amolA、bmolB、cmolC,达到平衡时C的体积分数为0.4,则a、b、c的取值可以是 。
a.a=2、b=1、c=2
b.a=0.5、b=1.7、c=1.7
c.a=1、b=1、c=1
d.a=x、b=c=2x(x>0)
e.b=c、a为大于0的任意值
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=_____________mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
计算过程:
(1)若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,计算a的值。
(2)反应达平衡时,混合气体的体积为537.6 L(标准状况下),其中NH3的体积分数为25%。求原混合气体中,a∶b=________。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。