T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。

已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=_____________mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平。D是一种日常生活中常用的调味品。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
(1)工业上,由石油获得石蜡油的方法是;
(2)丁烷是由石蜡油获得A过程中的中间产物之一,它的一种同分异构体中含有三个甲基,写出这种同分异构体的结构简式:;
(3)B、D分子中官能团的名称分别是、;
A→B的反应类型是;
写出反应B→C的化学方程式: ;
(4)大多数的有机反应速率比较缓慢,我们在实验或生产中为了提高有机反应的速率,通常采取的措施有(填一项即可)。
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同。请回答下列问题: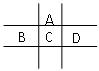
(1)B元素在周期表中的位置为;
(2)A与氢元素能形成原子物质的量之比为1:1的化合物,其电子式为;
(3)向D与E形成的化合物的水溶液中滴入NaOH溶液直至过量,观察到的现象是,最后阶段反应的离子方程式为 ;
(4)B、C、D、E的最高价氧化物的水化物的酸性从强到弱的顺序为(物质用化学式表示)。
(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是;仅发 生离子键破坏的是___仅发生离子键破坏的是;既发生离子键又发生共价键破坏的是______。
生离子键破坏的是___仅发生离子键破坏的是;既发生离子键又发生共价键破坏的是______。
(2)已知拆开1 mol H—H键、1 mol N≡N、1 mol N—H键分别需要吸收的能量为436kJ、946k J、391k J。则由N2和H2反应生成1 mol NH3
需要(填“放出”或“吸收”)的热量。
已知丁烷在催化剂、加热、加压的条件下会以如下两种方式发生裂解:
现有1 mol丁烷,其中有36%以方式①裂解,有24%以方式②裂解,还有40%没有裂解,则最终所得混合气体的平均摩尔质量是。
1 g CuO和木炭粉的混合物,在隔绝空气的条件下加热一段时间并冷却,质量变为 x g,
若反应中只产生CO2。
(1)实验中有g CuO被还原,(2)x的取值范围是。