在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g); =-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:

(1)该温度下此反应反应物的总键能和 (填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率 (H2)为 。
(H2)为 。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 (填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.Q1+Q2=a B.α3<α1
C.P3<2P1=2P2 D.n2<n3<1.0mol
(6)已知:①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
CH3OCH3(g) +CO2(g) △H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g) △H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g) △H= -41 kJ·mol-l
CO2(g)+H2(g) △H= -41 kJ·mol-l
2H2(g)+CO(g) CH3OH(g);
CH3OH(g); =-a KJ·mol-1,则a=
=-a KJ·mol-1,则a=
已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的相互反应
(1)写出下列物质的化学式:
A,B,D,丙。
(2)丙电子式为,反应②中若有11.2L(标准状况下)B生成,则发生转移的电
子的物质的量为。
(3)写出反应③的化学方程式:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X |
最外层电子数是内层电子数的3倍 |
| Y |
第三周期元素的简单离子中半径最小 |
| Z |
T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
(1)元素T与X按原子个数比1:1形成的化合物B所含化学键为,该化合物的电子式为。
(2)化合物A的溶液呈碱性,用离子方程式解释其原因:,该化合物起消毒作用的微粒是。
(3)将Y与Z形成的化合物的水溶液逐滴加入到T的最高价氧化物对应水化物的溶液中直至过量(边滴边振荡),写出此过程中发生反应的离子方程式
、。
硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1=" +1011.0" kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)="2CO(g)" ;ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4=kJ · mol-1,该反应能自发进行的原因是;工业上制备Na2S不用反应①,而用反应④的理由是。
(2)已知不同温度下2SO2+O2 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
| 温度(℃) |
527 |
758 |
927 |
| 平衡常数 |
784 |
1.0 |
0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为。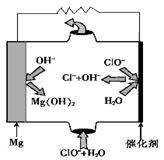
利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2,其部分工艺流程如下: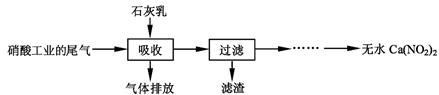
请回答下列问题:
(1)一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)  N2O3(g),其平衡常数表达式为K=。
N2O3(g),其平衡常数表达式为K=。
(2)上述工艺中采用气液逆流接触吸收(尾气从吸收塔底部进入,石灰乳从吸收塔顶部喷淋),其目的是;滤渣可循环利用,滤渣的主要成分是(填化学式)。
(3)该工艺需控制NO和NO2物质的量之比接近1︰1。若n(NO):n(NO2)>1︰1,则会导致;若n(NO):n(NO2)<1︰1,则会导致。
(4)生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,其反应的离子方程式。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
请回答下列问题:
(1)由滤液A制得AlCl3溶液有途径Ⅰ和Ⅱ两条,你认为合理的是,理由是:
。
(2)从滤液E中得到绿矾晶体的实验操作是。
(3)请用一个总反应式表示由滤渣F制备胆矾晶体过程中发生的变化:
。
(4)有同学提出可将方案中最初溶解合金的烧碱改用盐酸,重新设计方案,也能制得三种物质,你认为后者的方案是否更合理,理由是
。