元素的性质呈周期性变化的根本原因是( )
| A.随着元素相对原子质量的递增,量变引起质变 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子的核外电子排布呈周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
下列俗语或警句中不涉及化学反应原理的是( )
| A.“真金不怕火炼” |
| B.“冰冻三尺,非一日之寒” |
| C.“火要空心,人要虚心” |
| D.“酒越陈越香” |
某化合物6.4g在氧气中完全燃烧,只生成8.8g CO2和7.2 g H2O。说法正确的是( )
| A.该化合物仅含碳、氢两种元素 |
| B.该化合物中碳、氢原子个数比为1:4 |
| C.无法确定该化合物是否含有氧元素 |
| D.该化合物一定是C2H8O2 |
已知化合物A( )与立方烷(
)与立方烷(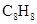 )的分子结构相似,如下图:
)的分子结构相似,如下图: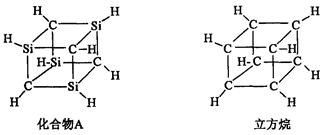
则 的二氯代物的同分异构体数目为( )
的二氯代物的同分异构体数目为( )
| A.3 | B.4 | C.5 | D.6 |
具有解热镇痛及抗生素作用的药物“芬必得”主要成分的结构简式为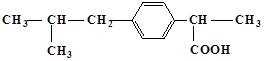 ,它属于( )
,它属于( )
①芳香族化合物②脂肪族化合物③有机羧酸④有机高分子化合物⑤芳香烃
| A.③⑤ | B.②③ | C.①③ | D.①④ |
某有机物其结构简式如图,关于该有机物,下列叙述不正确的是( )
| A.能与NaOH的醇溶液共热发生消去反应 | B.能使溴水褪色 |
| C.一定条件下,能发生加聚反应 | D.一定条件下,能发生取代反应 |