下列关于热化学方程式 H2(g)+
H2(g)+ I2(g)=HI(g) △H=-4.5 kJ•mol-1的叙述正确的是( )
I2(g)=HI(g) △H=-4.5 kJ•mol-1的叙述正确的是( )
| A.1mol H2和1mol I2完全反应放出4.5kJ热量 |
| B.1个氢分子和1个碘分子完全反应放出9kJ热量 |
| C.1mol H2和1mol I2完全反应生成气态HI放出9kJ热量 |
| D.0.5mol H2和0.5mol I2完全反应需要吸收4.5kJ热量 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.向煤中加入适量的石灰石,可以减少燃烧产物中SO2的量 |
| B.加热能杀死甲型H1N1流感病毒是因为构成病毒的蛋白质受热变性 |
| C.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 |
| D.废旧电池应集中回收,并填埋处理 |
为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是( )
| A.合金中镁的质量分数为63.3%≤Mg%<100% |
| B.该合金中含有铝的质量至少为5.4 g |
| C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2 |
| D.在产生沉淀后的溶液中有1.5 mol Na2SO4 |
25℃时,下列溶液中有关微粒的物质的量浓度关系错误的是( )
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+)=c(OH-) + c(A-)
B.Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
C.将醋酸钠、盐酸两溶液混合后呈中性的溶液中:c(Na+)>c(Cl—)=c(CH3COOH)
D.pH=4的NaHA溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
已知芳香烃A、B的结构模型如下图所示,相关叙述正确的是( )
A.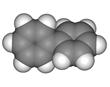 B.
B.
A.A的结构简式为 ,其一氯代物有2种
,其一氯代物有2种
B.A中有两种不同类型的碳碳键
C.B与A互为同系物,通式为CnH4n+2(n为苯环数)
D.与B互为同类别物质的同分异构体共有2种
测定Cu(NO3)2∙nH2O的结晶水含量,下列方案中不可行的是( )
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| D.称量样品→加NaOH→过滤→加热→冷却→称量CuO |