为探究原电池的形成条件和反应原理,某同学设计了如下实验,并记录了实验现象:
①向一定浓度的稀硫酸中插入锌片,看到有气泡生成;
②向上述浓度的稀硫酸中插入铜片,没有气泡生成;
③将锌片与铜片上端接触并捏住,一起插入上述浓度的稀硫酸中,看到铜片上有气
泡生成,且生成气泡的速率比实验①中快;
④在锌片和铜片中间接上电流计,再将锌片和铜片插入上述浓度的稀硫酸中,发现
电流计指针偏转.
下列关于以上实验设计及现象的分析,不正确的是( )
| A.实验①、②说明锌能与稀硫酸反应而铜不能 |
| B.实验③说明发生原电池反应时会加快化学反应速率 |
| C.实验③说明在该条件下铜可以与稀硫酸反应生成氢气 |
| D.实验③、④说明该原电池中铜为正极、锌为负极 |
对于敞口容器中的化学反应Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ,下列叙述 不正确的是
不正确的是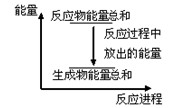

X、Y元素均为主族元素,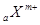 和
和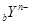 的电子层结构相同,则下列说法中不正确的是
的电子层结构相同,则下列说法中不正确的是
A.Y元素的核电荷数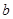 等于 等于 |
| B.Y的原子序数小于X的原子序数 |
C.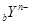 的离子半径小于 的离子半径小于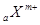 的离子半径 的离子半径 |
D.若X元素位于 周期,则Y元素位于 周期,则Y元素位于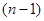 周期 周期 |
在化学学习与研究中类推的思维方法有时会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,正确的是()
| A.SO2能与碱反应,推测:非金属氧化物都能与碱反应 |
| B.金属钠着火不能用CO2扑灭,推测:金属钾着火也不能用CO2扑灭 |
| C.Fe3O4可表示为FeO·Fe2O3,推测:Pb3O4也可表示为PbO·Pb2O3 |
| D.F-Cl-Br-I的单质熔点依次升高,推测:N-P-As-Sb-Bi的单质熔点也依次升高 |
在福岛核泄漏事故中,检测到的放射性物质包括碘—131、铯—137和钚—239等。硼具有阻止反应堆内核分裂,降低反应堆温度的功能。下列说法正确的是()
| A.钚—239的质子数为239 | B.氢氧化铯的碱性比氢氧化钾强 |
| C.碘元素的相对原子质量为131 | D.硼酸的酸性比铝酸(氢氧化铝)弱 |
常温下,0.1mol·L-1某一元酸HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是
A.该溶液中由水电离出的c(H+)=1×10-11 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A—)>c(OH―)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则
c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1mol·L-1HA溶液与0.05mol·L-1NaOH溶液等体积混合后所得溶液中
2c(H+)+c(HA)=c(A-)+2c(OH-)