下列有关热化学方程式的叙述正确的是()
A.已知2H2(g)+O2(g) 2H2O(g);△H= —483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol 2H2O(g);△H= —483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
B.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l);△H=-57.4kJ/mol NaCl(aq)+H2O(l);△H=-57.4kJ/mol |
| C.己知2C(s)+2O2(g)=2CO2(g);△H1 ;2C(s)+O2(g)=2CO(g);△H2则△H1>△H2 |
D.在密闭容器中,发生化学反应:2NO(g)+2CO(g)  N2(g)+2CO2(g);∆H= -QkJ/mol现充入NO和CO各4 mol 进行反应,反应结束时,反应放热2QkJ N2(g)+2CO2(g);∆H= -QkJ/mol现充入NO和CO各4 mol 进行反应,反应结束时,反应放热2QkJ |
右图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是()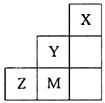
| A.非金属性:Y>Z>M |
| B.离子半径:M->Z2->Y- |
| C.ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D.三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列在限定条件溶液中的各组离子,能够大量共存的是()
| A.pH="3" 的溶液:Na+、Fe2+、Cl-、ClO- |
| B.在强碱性溶液中:Na+、Al3+、AlO2-、CO32-、SiO32- |
C.使酚酞试液变红的溶液:Na+、Al3+、SO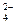 、Cl- 、Cl- |
| D.水电离的H+浓度为1×10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br- |
在aLNa2SO4和Fe2(SO4)3的混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-完全沉淀,加入足量强碱可得到cmol Fe(OH)3沉淀,则原溶液中Na+的浓度为()
A.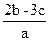 |
B.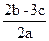 |
C.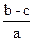 |
D.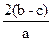 |
下列离子方程式中正确的是()
| A.用氯气作为水的消毒剂: Cl2+H2O = 2H++Cl-+ClO- |
B.向AlCl3溶液中加入过量氨水:Al3+ + 4NH3• H2O  AlO2-+ 4NH4+ + 2H2O AlO2-+ 4NH4+ + 2H2O |
| C.向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性: Ba2+ + OH- + H+ + SO4  2-= BaSO4↓+ H2O 2-= BaSO4↓+ H2O |
| D.KI溶液与H2SO4酸化的H2O2溶液混合: 2 I- + H2O2 + 2 H+ ="2" H2O + I2 |