下列离子方程式正确的是 ( )
| A.用浓盐酸与二氧化锰反应制取少量氯气: MnO2 + 4H+ +2Cl— 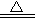 Mn2+ +Cl2↑ + 2H2O Mn2+ +Cl2↑ + 2H2O |
| B.铜与稀硝酸反应: Cu+4H++2NO3-==Cu2++2NO↑+2H2O |
| C.硅酸钠溶液中通人过量二氧化碳: SiO32-+2CO2+2H2O = H2SiO3↓+2HCO3- |
| D.氟气与溴化钠溶液反应:F2+2Br—====2F—+Br2 |
某高校研究课题组利用生物发酵技术生产灵芝酸单体的分子结构图如右图所示,下列关于该有机物的说法不正确的是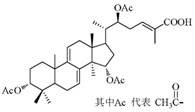
| A.能与Br2发生加成反应 |
| B.能发生酯化反应 |
| C.能发生水解反应 |
| D.分子中有7 个手性碳原子 |
将CHCOOH和H18O-C2H5混合发生酯化反应,己知酯化反应是可逆反应,反应达到平衡后,下列说法正确的是
| A.18O存在于所有物质里 |
| B.18O仅存在于乙醇和乙酸乙酯里 |
| C.18O仅存在于乙醇和水里 |
| D.有的乙醇分子可能不含18O |
有机物甲的分子式为C7H14O2在酸性条件下甲水解为乙和丙两种有机物.在相同的温度和压强下,同质量的乙和丙两种有机物的蒸气所占体积相同.则甲的可能结构为
| A.2 种 | B.4种 | C.8种 | D.16种 |
某期刊封面上一个分子球棍模型图如图所示,图中“棍”代表单键、双键或三键,不同颜色的球代表不同元素的原子。该模型图可代表一种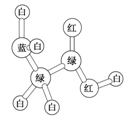
| A.醇 | B.酸 | C.酯 | D.氨基酸 |
下列有关金属腐蚀与防护的说法正确的是
| A.纯银器表面在空气中因电化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |