A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E是地壳中含量最高的金属元素。
根据以上信息回答下列问题:
(1)D元素在周期表中的位置是 ,乙物质的晶体中所含化学键的类型为 ,阴离子与阳离子的个数比为 ,其电子式为 。
(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)。
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是
。
(4)请设计比较D与E金属性强弱的实验方法(简述实验步骤、现象与结论):
。
镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。主要步骤如下: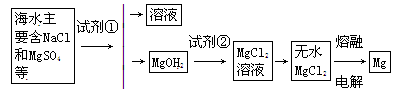
(1)为了使MgCl2转化为Mg(OH)2,试剂①可以选用。试剂②可以选用。
(2)验证MgCl2已完全转化为Mg(OH)2的方法是。
(3)由MgCl2溶液得到无水MgCl2的方法是。
食品添加剂必须严格按照食品安全国家标准(GB2760-2011)的规定使用。常作为食品添加剂中的防腐剂W,可以经过如下反应路线合成(部分反应条件略)。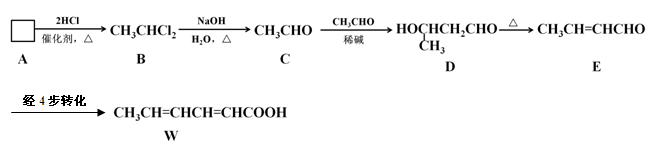
(1)已知A→B为加成反应,则A的结构简式为。
请用化学方程式表示实验室制取A的原理:。
(2)用D的同分异构体D1制备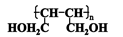 。
。
a、D1的结构简式为;
b、为避免副反应R-OH + R-OH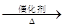 R-O-R + H2O的发生,合理的制备途径可以按照酯化反应、
R-O-R + H2O的发生,合理的制备途径可以按照酯化反应、
、的顺序依次进行(填反应类型)。
(3)已知乙烯不能被弱氧化剂氧化。依C→D→E的原理,由E制备W的4步转化为:
第1步:(用化学方程式表示);
第2步:消去反应;
第3步:(用化学方程式表示);
第4步:加适量稀酸酸化,提纯。
(共14分)对二甲苯(英文名称p-xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式。
(2)PX可发生的反应有、(填反应类型)。
(3)增塑剂(DEHP)存在如下图所示的转化关系,其中A是PX的一种同分异构体。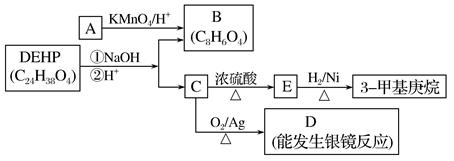
①B的苯环上存在2种不同化学环境的氢原子,则B的结构简式是。
②D分子所含官能团是(填名称)。
③C分子有1个碳原子连接乙基和正丁基,DEHP的结构简式是。
(4)F是B的一种同分异构体,具有如下特征:
a.是苯的邻位二取代物;
b.遇FeCl3溶液显示特征颜色;
c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式。
糖类、油脂和蛋白质在人类的生命活动过程中起重要作用,请根据糖类、油脂、蛋白质的有关性质回答下列问题:
(1)糖尿病是由于人体内胰岛素紊乱所导致的代谢紊乱综合症,以高血糖为主要标志。血糖是指血液中的葡萄糖(C6H12O6)。下列说法正确的是______________。
A、葡萄糖属于碳水化合物,分子式可表示为C6(H2O)6,则每个葡萄糖分子中含6个H2O
B、糖尿病人尿糖较高,可用新制的氢氧化铜悬浊液来检测病人尿液中的葡萄糖
C、葡萄糖可用于制镜工业
D、淀粉水解的过程中可以产生麦芽糖和蔗糖
(2)糖尿病人宜多吃蔬菜和豆类食品。蔬菜中富含纤维素,豆类食品中富含油脂和蛋白质。下列说法中错误的是_______________。
A、油脂和蛋白质都属于天然有机高分子化合物,蛋白质都不溶于水
B、用灼烧闻气味的方法可以区别合成纤维和羊毛
C、人体内不含纤维素水解酶,人不能消化纤维素,因此蔬菜中的纤维素对人没有用处
D、紫外线、医用酒精能杀菌消毒,是因为可以使细菌的蛋白质变性
(3)某种蛋白质的结构片段如右图:
上述蛋白质结构片段完全水解所生成的氨基酸中属于芳香族化合物的是:__ ___。
(4)已知上述蛋白质结构片段的相对分子质量是307,则水解生成的各种氨基酸的相对分子质量之和为。
对比同体积、同浓度的盐酸和醋酸,c(H+)前者后者,与碱完全中和时,消耗NaOH的物质的量是前者后者,与足量的Zn反应产生H2的速率是前者后者,产生H2的量是前者后者。(填“>”、“<”或“=”)