食品添加剂必须严格按照食品安全国家标准(GB2760-2011)的规定使用。常作为食品添加剂中的防腐剂W,可以经过如下反应路线合成(部分反应条件略)。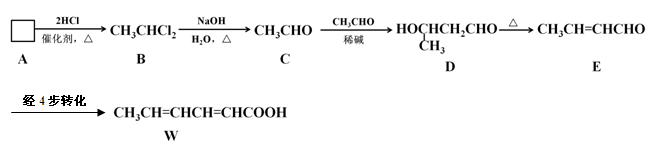
(1)已知A→B为加成反应,则A的结构简式为 。
请用化学方程式表示实验室制取A的原理: 。
(2)用D的同分异构体D1制备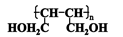 。
。
a、D1的结构简式为 ;
b、为避免副反应R-OH + R-OH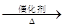 R-O-R + H2O的发生,合理的制备途径可以按照酯化反应、
R-O-R + H2O的发生,合理的制备途径可以按照酯化反应、
、 的顺序依次进行(填反应类型)。
(3)已知乙烯不能被弱氧化剂氧化。依C→D→E的原理,由E制备W的4步转化为:
第1步: (用化学方程式表示);
第2步:消去反应;
第3步: (用化学方程式表示);
第4步:加适量稀酸酸化,提纯。
设水的电离平衡曲线如图所示: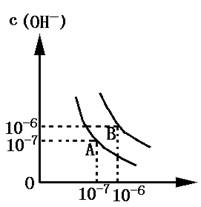
⑴若以A点表示水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从增加到.
⑵将pH=8的Ba(OH)2溶液与PH=5的稀盐酸相混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2与盐酸的体积比为
同素异形体相互转化的反应热相当少而且转化速率较慢,有时还很不完全,测定反应热很困难,现在可根据盖斯定律进行计算。
已知:P4(固体.白磷)+5O2(气体)= P4O10(固体) △H=-2983.2kJ·mol-1 ①
P(固体.红磷)+O2(气体)=P4O10(固体) △H=-738.5kJ·mol-1 ②
⑴由热化学方程式来看,更稳定的磷的同素异形体是
⑵试写出白磷转化为红磷的热化学方程式
(共4分) A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题:
⑴若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:
⑵若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式是
(共14分)下表中阿拉伯数字(1、2…)是元素周期表中行或列的序号。请参照元素A~J在周期表中的位置,回答下列问题:
| 纵行 横行 |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
18 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
F |
G |
H |
E |
I |
J |
⑴上表中元素的最高价氧化物对应的水化物中碱性最强的是_____________(用化学式表示)、酸性最强的是______________(用化学式表示);
⑵J的原子结构示意图为____________;C在周期表的第_________族;
⑶最高价氧化物对应的水化物能与其气态氢化物化合生成盐的元素是________;
⑷D、E、F、G四种元素简单离子的离子半径由大到小的顺序是(用化学符号表示)___________>____________>_____________>_____________;
⑸请设计一个简单的实验证明C元素的非金属性比B强(只写化学方程式)__________________
已知:2Fe3++2I-===2Fe2++I2
2Fe2++Br2===2Fe3++2Br-
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子
是_____________,被氧化的离子的物质的量分别是________。
(2)如果向原溶液中通入3 mol Cl2,则被氧化的离子是________,其对应的氧化产物的物质的量分别是_____________。
(3)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+、Br-完全被氧化时,c________(用含a、b的代数式表示)。