硅及其化合物广泛应用于太阳能的利用、光导纤维及硅橡胶的制备等。
纯净的硅是从自然界中的石英矿石(主要成分为SiO2)中提取的。高温下制取纯硅有如下反应(方法1):
①SiO2(s)+2C(s) Si(s)+2CO(g)
Si(s)+2CO(g)
②Si(s)+2Cl2(g) SiCl4(g)
SiCl4(g)
③SiCl4(g)+2H2(g) →Si(s)+4HCl(g)
完成下列填空:
(1)硅原子核外有 种不同能级的电子,最外层的p电子有 种自旋方向。
(2)硅与碳同主族,单质的还原性:碳 硅(填写“同于”、“强于”或“弱于”)。反应①之所以能进行的原因是 。
(3)反应②生成的化合物的电子式为 ;该分子为 分子(填写“极性”或“非极性”)。
(4)某温度下,反应②在容积为V升的密闭容器中进行,达到平衡时Cl2的浓度为a mol/L。然后迅速缩小容器容积到0.5V升,t秒后重新达到平衡,Cl2的浓度为b mol/L。则:a b(填写“大于”、“等于”或“小于”)。
(5)在t秒内,反应②中v(SiCl4)= (用含a、b的代数式表示)。
(6)工业上还可以通过如下反应制取纯硅(方法2):
④Si(粗) +3HCl(g)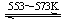 SiHCl3(l)+H2(g) + Q(Q>0)
SiHCl3(l)+H2(g) + Q(Q>0)
⑤SiHCl3(g)+H2(g)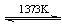 Si(纯)+3HCl(g)
Si(纯)+3HCl(g)
提高反应⑤中Si(纯)的产率,可采取的措施有: (选填2条)。
写出下列变化的化学方程式
①制乙炔:
②实验室制乙烯:
③制三硝基甲苯:
盐酸利多卡因(F)葡萄糖注射液抗心律失常,可用于急性心肌梗死后室性早搏和室性心动过速。合成路线流程图如下: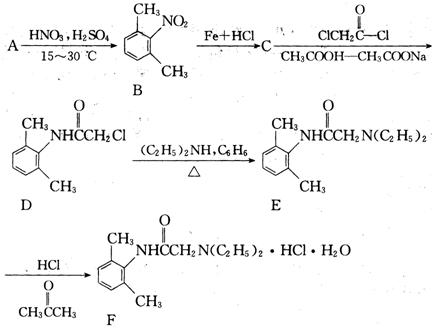
(1)B在核磁共振氢谱上有种特征峰,C→D的反应类型是 。
。
(2)B的同分异构体种类很多,符合以下条件的B的同 分异构体共有种。
分异构体共有种。
①属于苯的衍生物,苯环上共有三个取代基;
②与碳酸钠溶液反应可放出CO2气体。
(3)写出 与足量的NaOH溶液共热充分反应后所得产物化学式中含三个氧原子,则1mol该物质最终消耗NaOH为mol。
与足量的NaOH溶液共热充分反应后所得产物化学式中含三个氧原子,则1mol该物质最终消耗NaOH为mol。
(4)现仅以有机物CH3CH=CHCH3为原料,无机试剂任选,用反应流程图表示合成有机物CH3COOCH2CH=CHCH2OOCCH3的过程(要注明反应条件等)。
提示:
相对分子质量为58的烃或烃的含氧衍生物有多种。请写出符合下列条件的结构简式。
(1)分子结构中含有三个—CH3的是;
(2)分子结构中有一个—CH3,且能发生银镜反应的是;
(3)分子结构中无—CH3,也无—OH,但能发生银镜反应的是;
(4)能和金属钠反应且不能使溴的四氯化碳溶液褪色的化合物。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4混合而成,为检验它的成分做了如下实验:
①将固体混合物溶于水,搅拌后得无色透明溶液
②往此溶液中滴加硝酸钡溶液,有白色沉淀生成
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,试判断:
(1)固体混合物中肯定有,肯定没有。
(2)写出②中可能发生的化学方程式_____________________________________
(3)写出③反应中的离子方程式 ____________________________________________
填空题
(1)标况下0.5 mol臭氧(O3)中含有O3的分子数目是含有O原子的物质的量为所占的体积为。
(2)下列物质:①Na②Na2O③CO2④NH3⑤HCl⑥H2SO4 ⑦Ba(OH)2⑧蔗糖⑨NaCl溶液。
属于电解质的是,属于非电解质的是,能导电的是。
(3)在Fe2O3 +3CO 2Fe+3CO2的的中,是氧化剂,是还原剂,元素被氧化,元素被还原。
2Fe+3CO2的的中,是氧化剂,是还原剂,元素被氧化,元素被还原。