(1)下列方法可以证明2HI(g)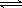 H2(g)+I2(g)已达平衡状态的是
H2(g)+I2(g)已达平衡状态的是
①单位时间内生成nmolH2的同时生成nmolHI;
②一个H-H 键断裂的同时有两个H-I键断裂;
③反应速率v(H2)=v(I2)=0.5v(HI)时;
④C(HI)=c(H2)=c(I2)=2:1:1且保持不变;
⑤温度和体积一定时,某一生成物浓度不再变化;
⑥温度和体积一定时,容器内压强不再变化;
⑦温度和压强一定时混合气体密度不再变化
(2)硫酸生产中炉气转化反应为:2SO2(g)+O2(g)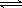 2SO3(g)。研究发现,
2SO3(g)。研究发现,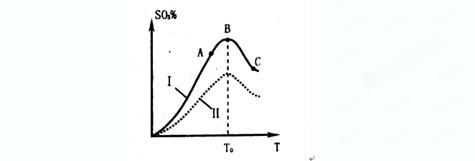
SO3的体积分数(SO3%)随温度(T)的变化如上图所示:
下列判断正确的是
A. 该反应的正反应为放热反应
B.曲线I上A、C两点反应速率的关系是:VA>VC
C. 反应达到B点时,2V正(O2)=V逆(SO3)
D.已知V2O5的催化效果比Fe2O3好,若I表示用V2O5作催化剂的曲线,则II是Fe2O3作催化剂的曲线
27.书写下列物质的结构简式
(1)2-甲基-1-丁烯,
(2)支链上只有一个乙基,且式量最小的烷烃,
(3) 相对分子质量为72且沸点最低的烷烃的结构 简式。
简式。
(1)下列各组物质属于同系物的是__________,属于同分异构体的是____________,属于同素异形体的是____________,属于同位素的是____________,属于同一种物质的是____________。
①O2和O3 ②氕和氚 ③麦芽糖和蔗糖 ④苯和对二甲苯 ⑤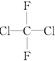 和
和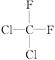
⑥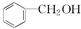 和
和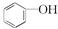 ⑦C2H2和C4H6 ⑧
⑦C2H2和C4H6 ⑧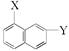 和
和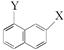 ⑨乙醇和甲醚 ⑩淀粉和纤维素 ⑪CH3CH2NO2和
⑨乙醇和甲醚 ⑩淀粉和纤维素 ⑪CH3CH2NO2和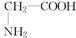
(2)、(3分)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填写在横线上:
乙烷(乙烯)苯(溴);乙炔(H2S)。
(3).若1 mol 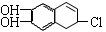 分别与浓溴水和NaOH溶液完全反应
分别与浓溴水和NaOH溶液完全反应 ,消耗Br2和NaOH的物质的量分别是mol和mol。
,消耗Br2和NaOH的物质的量分别是mol和mol。
某河道两旁有甲、乙两厂。它们 排放的工
排放的工 业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO
业废水中,共含K+、Ag+、Fe3+、C1-、OH-、NO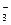 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、________、_______。
(2)乙厂的废水中含有另外三种离子。如果加一定量________(选填“活性炭”“铁粉”),可以回收其中的________ (填写金属元素符号)。
(填写金属元素符号)。
标准状况下的67.2 L HCl气体含有的HCl的物质的量为____ ____mol,分子数为_____ __,含有HCl的质量为g,将同量该气体溶于水制成500ml溶液,则溶液的物质的量浓度为。
写出下列反应的离子方程式:
(1)用稀硫酸清洗铁锈(Fe2O3)
(2)碳酸钠溶液与盐酸混合
(3)硫酸铜溶液和氢氧化钡溶液混合
(4)向足量澄清石灰水中通入二氧化碳