实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应: CO2(g)+3H2(g)
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量变化: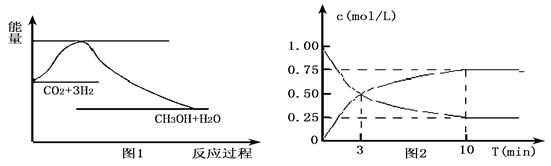
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和4mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
(3)25℃,1.01×105Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
现有A、B、C、D、E六种元素原子序数依次增大;只有E不是短周期元素;对其分别描述如下表:
| 元素编号 |
元素描述 |
| A |
单质是最理想的气体燃料;而氧化物是最常用的液态灭火剂 |
| B |
氧化物之一不但能造成酸雨,还能造成光化学烟雾 |
| C |
所处周期数、族序数都与电子层数相等 |
| D |
最高化合价为+7 |
| E |
目前用量最大,应用最广泛的金属 |
(1)元素D的最高价氧化物为无色液体, 0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式;
(2)用一个化学方程式表示C与E的金属性强弱。
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是。
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是。(用离子方程式表示)
(5)E单质在海水中易被腐蚀,写出正极反应式:。
建筑工地常用的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应:
(1)配平并标出电子转移的方向和数目。
(2)上述反应的氧化剂是;若有1 mol的还原剂被氧化,则反应中转移电子的的数目是。
(3)根据上述反应,可用试纸和生活中常见的物质进行实验,以鉴别NaNO2和NaCl,可选用的物质有:①水②碘化钾淀粉试纸③淀粉④白酒⑤食醋,进行实验,下列几组合适的是(填序号)。
| A.③⑤ | B.①②④ |
| C.①②⑤ | D.①②③⑤ |
(4)某厂废切削液中,含有2%—5%的NaNO2,直接排放会造成污染,采用NH4Cl,能使NaNO2转化为不引起二次污染的N2,反应的化学方程式为 ;该反应中被氧化的元素是。
(5)采用烧碱处理硝酸工业尾气可以获得副产品NaNO2,变废为宝。若采用aL bmol/L的烧碱处理硝酸工业尾气,最多可以获得NaNO2的物质的量为mol。
(1)1mol H2O和1mol H2O2相比较,分子数之比为:_______________
氧原子数之比为:_________________; 质量之比为:________________
(2).实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。
取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为__________,参加反应的HCl有________mol。
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度。(写出规范的解题过程) (5分)
取100 mLNa2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51g白色沉淀和滤液,再加过量稀硝酸处理沉淀,最后减少到4.66g,并有气体放出。
(1)写出上述过程中有关反应的离子方程式:_______________________________________
_________________________________________________________________________(4分)
(2)原混合液中Na2SO4的物质的量浓度为_________________ (2分)
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此回答下列问题:
(1)该硫酸的物质的量浓度为 mol/L。
(2)配制250mL 0.92mol·L-1的稀硫酸需取该硫酸mL。
(3)配制时必需的玻璃仪器有:
(4)定容时,待容量瓶中溶液的凹液面正好与刻度线相切,盖好瓶塞后的下一步操作是________________________________________________。
(5)定容时,若加入的水超过刻度线,必须采取的措施是
(6)下列操作对H2SO4的物质的量浓度有什么影响(偏高、偏低或无影响)?
①转移溶液后,未洗涤烧杯: ;
②容量瓶用水洗净后未烘干: ;
③定容时俯视容量瓶的刻度线: 。