现有A、B、C、D、E六种元素原子序数依次增大;只有E不是短周期元素;对其分别描述如下表:
| 元素编号 |
元素描述 |
| A |
单质是最理想的气体燃料;而氧化物是最常用的液态灭火剂 |
| B |
氧化物之一不但能造成酸雨,还能造成光化学烟雾 |
| C |
所处周期数、族序数都与电子层数相等 |
| D |
最高化合价为+7 |
| E |
目前用量最大,应用最广泛的金属 |
(1)元素D的最高价氧化物为无色液体, 0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式 ;
(2)用一个化学方程式表示C与E的金属性强弱 。
(3)A与B两种元素组成一种阳离子,检验某溶液中含有该离子的方法是 。
(4)含C的某化合物可用作净水剂,该物质的水溶液呈酸性,其原因是 。(用离子方程式表示)
(5)E单质在海水中易被腐蚀,写出正极反应式: 。
某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下两步操作: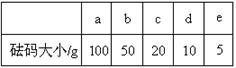
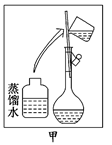
第一步:配制500 ml 烧碱样品溶液。
(1)检查容量瓶是否漏液的方法是:往瓶内加入一定量水,塞好瓶塞。
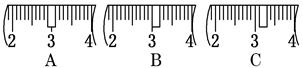
(2)用质量为13.1 g的空烧杯,需要称取烧碱样品20 g。则放在托盘天平上称取时,最终选取所需的砝码为 (填附表中的字母),并在下图中选出能正确表示游码位置的选项 (填字母)。
 |
附表:砝码规格附:游码位置
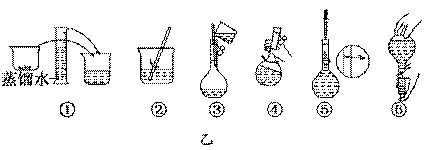
(3) 配制溶液的操作步骤如下图的乙图所示,则甲图操作应在乙图中的 (填选项字母)之间。
A.①与② B. ②与③ C.③与④ D.④与⑤
 |
第二步:中和滴定,以确定烧碱样品的纯度。
A.用碱式滴定管量取25.00 mL烧碱溶液于锥形瓶中,并滴入几滴酚酞作指示剂
B.将浓度为c mol / L的硫酸标准溶液装入润洗好的酸式滴定管中,调节液面使开始读数为V1 mL
C.在锥形瓶下垫一张白纸,滴定至终点时,记下读数为V2 mL
试填空:
(1)滴定至终点的判定标准是:当加入最后一滴硫酸溶液时,溶液的颜色由色变为色。
(2)C步骤的操作中,锥形瓶下垫一张白纸的作用是。
(3)该烧碱样品纯度为_________________________。
为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作: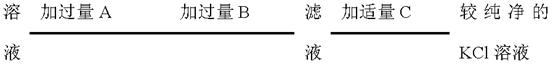
(1)写出三种试剂的化学式:A,B,C。
(2)加过量A的原因是
有关反应的化学方程式为:
(3)加过量B的原因是:
有关反应的化学方程式为:
有一包白色粉末,可能由KCl、BaCO3、BaCl2、KNO3、NH4NO3和Na2SO4中的一种或几种组成。现进行下列实验:
(1)将此粉末溶于水中,得到无色透明溶液A及白色沉淀B,过滤。
(2)取沉淀物B,加稀HNO3后,沉淀物B不溶解。
(3)取少量溶液A,加入适量的NaOH溶液,加热,产生无色有刺激性气味并能使湿润的红色石蕊试纸变蓝色的气体。
(4)再取少量溶液A,滴入AgNO3溶液,充分反应后,有白色沉淀生成,该沉淀不溶于稀硝酸。
据此推断,该白色粉末中,一定含有,肯定不含有,可能含有。
NaCl溶液中含有少量的CaCl2,某学生用过量的Na2CO3使Ca2+离子转化为沉淀而除去,确认Na2CO3已过量的实验方法是
洗涤沉淀的方法是。
在反应X+2Y=R +2M中,已知R、M的摩尔质量之比为22:9。当1.6gX与Y完全反应后,生成4.4gR,则在此反应中,Y、M的质量之比为________
+2M中,已知R、M的摩尔质量之比为22:9。当1.6gX与Y完全反应后,生成4.4gR,则在此反应中,Y、M的质量之比为________