用FeCl3酸性溶液脱除H2S后的溶液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1 mol·L-1的FeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压数值):
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅰ |
x≥a |
电极附近出现黄色,有气泡产生 |
有Fe3+、有Cl2 |
| Ⅱ |
a>x≥b |
电极附近出现黄色,无气泡产生 |
有Fe3+、无Cl2 |
| Ⅲ |
b>x>0 |
无明显变化 |
无Fe3+、无Cl2 |
(1)用KSCN溶液检验出Fe3+的现象是_____________________。
(2)Ⅰ中,Fe3+产生的原因可能是Cl-在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:
__________________________。
(3)由Ⅱ推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有________性。
(4)Ⅱ中虽未检验出Cl2,但Cl-在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
| 序号 |
电压/V |
阳极现象 |
检验阳极产物 |
| Ⅳ |
a>x≥c |
无明显变化 |
有Cl2 |
| Ⅴ |
c>x≥b |
无明显变化 |
无Cl2 |
①NaCl溶液的浓度是________mol·L-1。
②Ⅳ中检测Cl2的实验方法_________________________。
③与Ⅱ对比,得出的结论(写出两点): 。
下表是某地区市场上销售的一种‘‘加碘食盐”的包装袋上的部分文字说明。
请根据此表,结合初中化学和生物学科的知识,回答下列问题。
| 配料表 |
精制海盐、碘酸钾 |
| 含碘量 |
20mg/kg~40 mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹调时,待食品熟后加入碘盐 |
(1)碘是合成下列哪种激素的主要原料之一
A.胰岛素 B.甲状腺素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到食盐供应,易患。
A.甲状腺亢进 B.贫血症C.地方性甲状腺肿大 D.糖尿病
(3)食盐中加碘,这碘指的是 (填“元素”、“原子”或“单质”)。
(4)碘酸钾的化学式为KIO3,其中碘元素的化合价为 。
(5)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易 。
(6)有人认为仅用淀粉溶液即可检验出食盐中是否加碘。你认为他的观点 (填 “正确”、“不正确”)。
(1)补充完成F表:(请把序号①一⑦的答案对应填入答题卡上)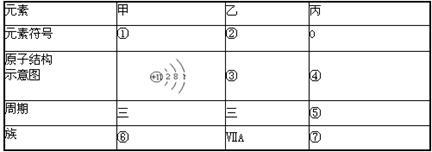
(2)甲元素最高价氧化物对应的水化物呈 性(填“酸、碱”),乙元素对应的最高价氧化物的水化物的化学式为 。
(3)甲与乙两元素的单质反应生成物的电子式为 。
(4)甲单质与丙的氢化物反应的化学方程式为 。
在Cu +2H2SO4(浓)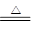 CuSO4+SO2↑+2H2O反应中,______________是氧化剂; ______________元素被氧化; ______________是氧化产物;电子转移总数为______________。
CuSO4+SO2↑+2H2O反应中,______________是氧化剂; ______________元素被氧化; ______________是氧化产物;电子转移总数为______________。
处于下列状态的物质中:①氯化钠晶体 ②干冰 ③液态醋酸 ④铜 ⑤硫酸钡晶体 ⑥蔗糖 ⑦酒精 ⑧熔融的硝酸钾 ⑨NaCl溶液
(1)属于电解质的是(填序号,下同) ;
(2)能导电的是 。
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。