亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。

(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
(10分)分子中只含有2个碳原子的某烃A是其同系物中含碳量最高的物质; 1mol A与1mol HCl加成可得到B;1mol A与1mol H2加成可得到C,并能继续发生如下列图表所示的转变:</PGN0306.TXT/PGN>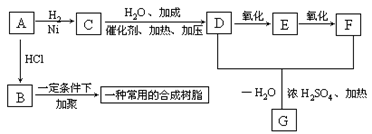
据此回答下列问题
(1) 写出实验室制取A的反应方程式 ___ _ ____________ ___ ____;
(2) 以B为原料经过加聚反应所得的合成树脂的结构简式为__ ___ _____。
(3) 写出由D和F生成G的反应方程式:
________________________ ________ __
(4) 写出E与银氨溶液反应的化学方程式:
___________ ____ ____ _________
(5) 写出符合以下两个条件的G的同分异构体,①能水解②能发生银镜反应:
医药阿斯匹林的结构简式如图1所示:
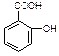
图1图2
试根据阿斯匹林的结构回答;
⑴阿斯匹林看成酯类物质,口服后,在胃肠酶的作用下,阿斯匹林发生水解反应,生成A和B 两种物质。其中A的结构简式如图2所示,则B的结构简式为;B中含有的官能团名称是。
⑵阿斯匹林跟NaHCO3同时服用,可使上述水解产物A与NaHCO3反应,生成可溶性盐随尿液排出,此可溶性盐的结构简式是。
⑶上述水解产物A与氢氧化钠溶液反应的化学方程式为
;
按要求填写:
⑴乙烯的电子式:;⑵油脂的结构通式:;
⑶甲苯制取TNT的反应方程式:;
⑷淀粉水解反应方程式:;
(8分)请选用适当的试剂和分离方法除去下列物质中所含的杂质(括号内为杂质),将所选的试剂及分离方法的编号填入表中。
试 剂: a.水 b.NaOH溶液 c.溴水 d.饱和Na2CO3溶液 e.新制CaO
分离方法:①.分液②.过滤③.洗气④.蒸馏
| 混合物 |
需加入的试剂 |
分离方法 |
| 溴苯(溴) |
||
| 乙烷(乙烯) |
||
| 乙醇(水) |
||
| 乙酸乙酯(乙酸) |
氯碱厂电解饱和食盐水制取NaOH溶液的工艺流程
示意图如下所示,完成下列填空: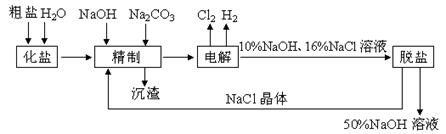
(1)在电解过程中,与电源正极相连的电极上电极反应为__________________________,与电源负极相连的电 极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
极附近,溶液pH_________(选填“不变”、“升高”或“下降”)。
(2)工业食盐含Ca2+、Mg2+等杂质,精制过程发生反应的离子方程式为
____________________________________________________________。
(3)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是_________。
a. Ba(OH)2 b. Ba(NO3)2 c. BaCl2
(4)为了有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_ ________(选填a、b、c)
________(选填a、b、c)
a. 先加NaOH,后加Na2CO3,再加钡试剂
b. 先加NaOH,后加钡试剂,再加Na2CO3
c. 先加Na2CO3,后加NaOH,再加钡试剂