以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下: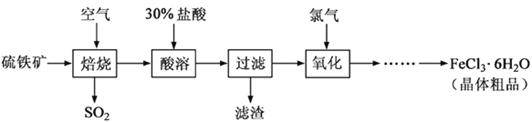
回答下列问题:
(1)硫铁矿高温焙烧的化学方程式为 ; 少量的SO2与NaOH溶液反应的离子方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是提高铁元素的浸出率和 ,
题问所涉及反应的离子方程式为 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
T ℃时,在容积为0.5 L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示。
已知:物质A、B、C均为气态、D为固态,正反应是吸热反应。根据要求回答下列问题:
(1)容器中反应的化学方程式为 。
(2)前2 min,v(A)=_____________mol·(min·L)-1。
(3)能说明该反应已达到平衡状态的是___________。
A.混合气体的压强不变
B.混合气体的密度不变
C.消耗0.1mol的B同时生成0.1mol的D
D.B的物质的量不变
(4)T ℃时,该反应的平衡常数K=_________________(保留小数点后两位)。
(5)反应达到平衡后,改变下列措施能使A的转化率增大的是________(填选项字母)。
A.只增加A的物质的量 B.移走一部分D
C.升高反应体系的温度 D.把容器的体积缩小一倍
恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
计算过程:
(1)若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,计算a的值。
(2)反应达平衡时,混合气体的体积为537.6 L(标准状况下),其中NH3的体积分数为25%。求原混合气体中,a∶b=________。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
计算过程:
(1)若反应进行到某时刻t时,nt(N2)=8mol,nt(NH3)=4mol,计算a的值。
(2)反应达平衡时,混合气体的体积为537.6 L(标准状况下),其中NH3的体积分数为25%。求原混合气体中,a∶b=________。
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
对于反应:N2(g)+3H2(g)  2NH3(g) ΔH<0
2NH3(g) ΔH<0
(1)能使正反应速率瞬时加快的因素有____________(填字母,下同);
(2)能使逆反应速率瞬时加快的因素有____________
| A.增大N2和H2的浓度 |
| B.增大压强 |
| C.升高温度 |
| D.加(正)催化剂 |
E.增加NH3浓度
F.减少NH3浓度
在体积不变的密闭容器里,通入x mol H2(g)和y mol I2(g),发生反应:
H2(g)+I2(g) 2HI(g)△H<0
2HI(g)△H<0
改变下列条件后,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ;(2)加入催化剂 ;
(3)充入更多的H2 ;(4)容器容积不变,通入氖气 。