某化学小组采用类似制乙酸乙酯的装置(如下图),以环己醇制备环己烯: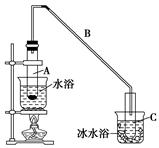
已知: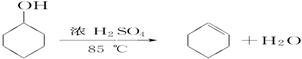
| |
密度(g/cm3) |
熔点(℃) |
沸点(℃) |
溶解性 |
| 环己醇 |
0.96 |
25 |
161 |
能溶于水 |
| 环己烯 |
0.81 |
-103 |
83 |
难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇
匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是________。
②试管C置于冰水浴中的目的是________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。先加入Na2CO3溶液,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用水洗涤。
②再将环己烯按下图装置蒸馏,冷却水从________口进入(填“g”或“f”)。蒸馏时要加入生石灰,目的是________________________________________。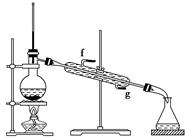
③实验制得的环己烯精品质量低于理论产量,可能的原因是________。
A.蒸馏时从70 ℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:


 图1图2
图1图2 ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。 ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。 回答下列问题:
回答下列问题: (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ; (2)塑料袋作用是: ;
(2)塑料袋作用是: ; (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:;相关的离子方程式是:。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是:;相关的离子方程式是:。
已知盐酸加到品红溶液中,使品红溶液的红色加深。试推测: (1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。 (2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。 (3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
(3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。

 可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳 已知:氢氧化钠溶液不与
已知:氢氧化钠溶液不与 反应,能与
反应,能与 反应
反应








(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论一局的试验现象是
该小组得出的结论一局的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
向该绿色溶液中通入氮气,观察颜色变化
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
实验室模拟合成氨和氨催化氧化的流程如下: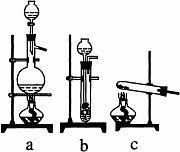

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:氮气 、氢气。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。






(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是。
(2)一定温度下,在恒容密闭容器中N2 O5可发生下列反应: 2N2O5(g) 4NO2(g)+O2(g);ΔH>0
2N2O5(g) 4NO2(g)+O2(g);ΔH>0
①反应达平衡后,若再通入一定量氮气,则N2O5的转化率将。(填“增大”或“减小”、“不变”)
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
1000 |
| c(N2O5)/mol·L-1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为。
③在T3温度下,反应1 000 s时测得NO2的浓度为4.98 mol·L-1,则T2T1。
 |
(3)如上图所示装置可用于制备N2O5,则N2O5在电解池的
区生成,其电极反应式为.