体积恒定的密闭容器中,反应2SO2(g)+O2(g) 2SO3(g) △H<0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
2SO3(g) △H<0达平衡后,采用下列措施一段时间后,既能增大逆反应速率又能使平衡向正方向移动的是
| A.通入大量O2 | B.增大容器容积 | C.移去部分SO3 | D.降低体系温度 |
用水热法制备Fe3 O4纳米颗粒的总反应如下:
O4纳米颗粒的总反应如下:
3 Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是
| A.在反应中硫元素被氧化,铁元素被还原 |
| B.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| C.每生成1mol Fe3O4,转移3mol电子 |
| D.当转移1mol电子时,消耗56g S2O32- |
将1 mol A(g)和2 mol B(g)置于2L某密闭容器中,在一定温度下发生反应: A(g)+B(g)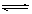 C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是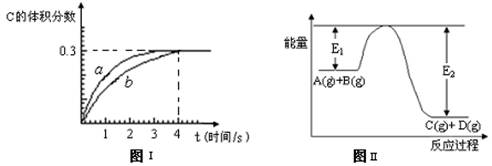
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol·L-1·s-1
B.该温度下,反应的平衡常数数值约为7.36
下列叙述正确的是
A.浓度均 为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性, 为0.1 mol·L-1的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,则:c(CH3COO-)<c(CH3COOH) |
B.浓度 均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中: 均为0.1 mol·L-1的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-) + c(NH3·H2O) |
| C.浓度均为0.1 mol·L-1的小苏打溶液和氢氧化钠溶液等体积混合: c(Na+)+ c(H+)=c(CO32-)+ c(OH-) + c(HCO3-) |
| D.用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点用去盐酸的体积小于10 mL |
下列图示与对应的叙述相符的是



图a图b图c图d
| A.图a表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图b中曲线表示反应2A(g) + B(g) 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 2C(g) ΔH > 0,正、逆反应的平衡常数K随温度的变化 |
C.图c表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图d,若除去CuSO4溶液中的Fe3+ 可向溶液中加入适量CuO至pH在4左右。 |
室温下,下列各组离子在指定溶液中能大量共存的是
| A.含有大量NO—2的水溶液中:Na+、Fe2+、SO2-4、H+ |
| B.在pH=12的溶液中:ClO—、S2-、Na+、K+ |
| C.能使pH试纸变蓝的溶液 NH4+Na+SO42-Fe3+ |
| D.含有大量HCO—3的澄清透明溶液中:K+、C6H5O—、Cl—、CH3COO— |