某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液。以0.14mol/L的NaOH溶液滴定上述稀H2SO4 25mL,滴定终止时消耗NaOH溶液15mL,其操作分解为如下几步:
| A.移取稀H2SO4 25.00 mL,注入洁净的锥形瓶中,并加入2-3滴指示剂。 |
| B.用蒸馏水洗涤滴定管,后用标准溶液润洗2-3次。 |
| C.取标准NaOH溶液注入碱式滴定管至 “0”或“0”刻度线以上。 |
| D.调节液面至 “0”或“0”以下某一刻度,记下读数。 |
E.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液。
F.把锥形瓶放在滴定管下面,用标准NaOH溶液滴定至终点,记下滴定管液面读数。
就此实验完成填空:
(1)①滴定操作的正确顺序是(用序号填写) 。
②该滴定操作中应选用的指示剂是 。
③在F操作中如何确定终点? 。
(2)该滴定过程中,造成测定结果偏高的原因可能有哪些 。
①配制标准溶液的NaOH中混有Na2CO3杂质
②滴定终点读数时,俯视滴定管的刻度,其他操作正确
③ 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
④滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
⑤滴定前碱式滴定管尖嘴部分未充满溶液
⑥滴定中不慎将锥形瓶内液体摇出少量于瓶外
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 mol/L(保留2位小数)
探究SO2的性质。甲组同学将SO2分别通入下列3种溶液中。
(1)试管a中观察到的现象是__________。
(2)试管b中观察到紫色褪去,说明SO2具有的性质是__________。
(3)试管c中产生了能溶于稀盐酸的白色沉淀,该白色沉淀是__________。
(4)乙组同学多做了一组实验,他们将SO2通入盛有1.0 mol/L Fe(NO3)3和BaCl2的混合溶液(已知1.0 mol/L Fe(NO3)3溶液中c(H+)=0.1 mol/L)的试管d中,得到了不溶于稀盐酸的白色沉淀。分析产生该白色沉淀的原因:
观点1:SO2与Fe3+反应
观点2:在酸性条件下SO2与 反应
反应
观点3:__________。
欲证明观点2,只需将试管d中Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是__________(填字母)。
a.0.1 mol/L稀硝酸
b.1.5 mol/L Ba(NO3)2和0.1 mol/L HNO3的混合溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
实验室需要65 mL 1.0 mol/L的NaCl溶液用于测定AgNO3溶液的浓度。
(1)用NaCl固体配制NaCl溶液时必须用到的仪器是__________(填序号)。
①天平②烧杯③玻璃棒④酒精灯⑤胶头滴管⑥50 mL容量瓶⑦100 mL容量瓶
(2)需要称取NaCl固体的质量是__________。
(3)量取20 mL AgNO3溶液,当加入25 mL 1.0 mol/L NaCl溶液时恰好完全反应,则c(AgNO3)=____。
下图是实验室制取并收集Cl2的装置。A是Cl2发生装置,E是硬质玻璃管中装有铜丝网;F为干燥的广口瓶,烧杯G为尾气吸收装置。
(1)A中发生的化学反应的离子方程式为。
(2)C中盛装的药品__________;
(3)E反应方程式为。
(4)写出G中反应的离子方程式。
(5)若将Cl2与SO2等物质的量通入水中则无漂白作用,试写出化学方程式。
(6)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O。
①当有0.2mole-转移时被氧化的HCl的质量是;
②如果将20ml 12mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将。
| A.≥1.68L | B.>1.68L | C.≤1.68L | D.<1.68L |
某学生试图用电解法根据电极上析出物质的质量来验证阿伏加德罗常数数值,其实验方案的要点为:①用直流电源电解CuCl2溶液,所用仪器如下图所示。②在电流强度为I A,通电时间为t min后,精确测得电极上析出铜的质量为m g。
试回答:(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示):
E接,C接,接F。
(2)写出B电极上发生的电极反应式:;
G试管中淀粉KI溶液变化的现象为,
相应的离子方程式是。
(3)为精确测定电极上析出的铜的质量,所必需的实验步骤的先后顺序应是。(选填下列操作步骤的编号)
①称量电解前电极质量②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后的电极④低温烘干电极后称量
⑤低温烘干刮下的铜后称量⑥再次低温烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿伏加德罗常数的计算式:NA=。
某课外学习小组的同学设计了如图的装置,以验证SO2的氧化性、还原性和漂白性(A中长颈漏斗上固定了多孔塑料板,用于放置块状固体)。回答以下问题: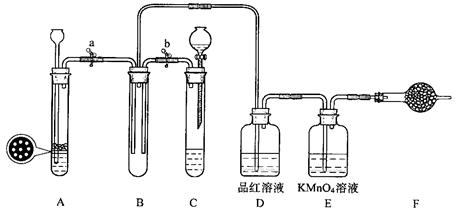
(1)用Na2SO3粉末和硫酸溶液制取SO2气体,应选用_____(选“A”或“C”)做气体发生装置。在确保气密性良好的情况下,小组同学仍发现产生气体的速率缓慢,可能的原因是(回答出一种即可)
(2)课外学习小组的同学用FeS块状固体和稀硫酸反应制取H2S气体,反应的方程式为;
(3)单独使SO2气体通过E装置时的现象是;
使SO2与H2S在B装置中混合,现象是_______________________________。
(4)F装置可用盛有溶液的洗气瓶代替。