理论上,SO2能发生类似CO2与澄清石灰水作用的反应,但在通常实验中,将SO2通入澄清石灰水却没有看到类似CO2那样先浑浊后澄清的现象。针对这一问题,研究性学习小组开展了探究性实验。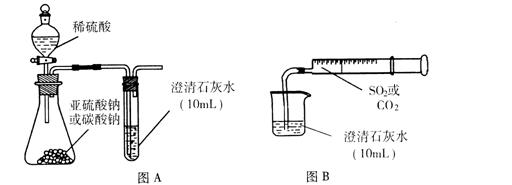
I.用图A所示的装置来分别做CO2、SO2与澄清石灰水的反应实验,结果通人CO2可看到先浑浊后澄清的现象,但通入SO2没看到浑浊现象。
Ⅱ.用图B的装置,将气体收集在注射器里,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,无论CO2还是SO2都能看到“先变浑再澄清”的现象。当以相同速率分别通人CO2或SO2,通入SO2产生现象明显比通入CO2产生现象快。
回答下列问题:
(1)通过上述I、Ⅱ实验,可以确定,将足量SO2缓慢通人澄清石灰水,依次发生的反应有:(用离子方程式表示) ; 。
(2)实验I中,通人SO2不能出现浑浊的原因可能是: 。
(3)实验Ⅱ中,同速率分别通入CO2或SO2,SO2产生现象比CO2快的相关因素有 。
①SO2在水中溶解度比CO2大。
②相同状态下,SO2的密度比CO2的密度大。
③亚硫酸酸性比碳酸强,在同温度、同体积的溶液中,l mol亚硫酸电离产生的H+离子浓度大于l mol碳酸电离产生的H+离子浓度。
④SO2有毒和刺激性气味, CO2无毒和无刺激性气味。
CO2无毒和无刺激性气味。
⑤相同条件下,1 mol SO2与足量石灰水反应生成CaSO3的速率大于1 mol CO2与足量石灰水反应生成CaCO3的速率。
⑥相同条件下,1 molCaSO3被1mol SO2(形成的H+离子)溶解形成可溶性Ca(HSO3)2
的速率大于1molCaCO3被1molCO2(形成的H+离子)溶解形成可溶性Ca(HCO3)2的速率。
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。
已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是_____________。
(2)吸收塔中的原料B可以选用____________(填字母序号)。
a.NaCl溶液 b.Na2CO3溶液c.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3的过程(加热装置已略去)。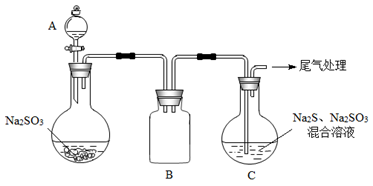
①A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是______。装置B的作用是_______。
②C中制备Na2S2O3发生的连续反应有:Na2S +H2O +SO2===Na2SO3 +H2S、_____和__________。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为_________________。
FeSO4•7H2O广泛用于医药和工业领域。以下是FeSO4•7H2O的实验室制备流程图。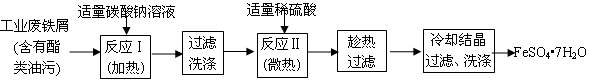
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为(用离子方程式表示)。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答),。
以下是测定某补血剂(FeSO4•7H2O)中铁元素含量的流程图。根据题意完成下列填空: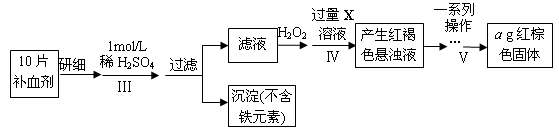
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及。
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③④冷却⑤称量⑥恒重操作。操作⑥的目的是。
(5)假设实验无损耗,则每片补血剂含铁元素的质量g(用含a的代数式表示)。
Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。
(反应方程式为: CaC2 + 2H2O→Ca(OH)2 + C2H2↑),请从下图中选用适当的装置,完成该实验。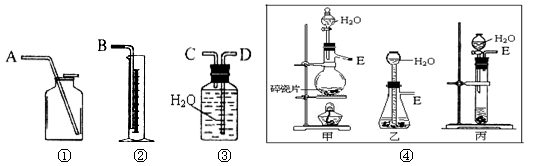
(1)制取C2H2最好选④中的,所选用装置的连接顺序是(填各接口A~E的顺序):。
(2)若实验时称取的试样为1.4g,产生的乙炔在标准状况下的体积为448mL,此试样中CaC2的质量分数为______________。(保留3位有效数字)
Ⅱ.某同学在实验室从如下图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物。
根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称_________。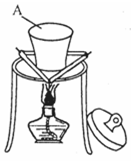
(2)此氧化物可能是_____或_____(写化学式)
(3)对黑色固体物质的组成作如图所示探究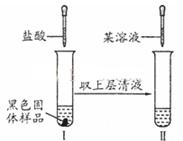
①实验I加入盐酸溶液的目的是_______;
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)
| 实验操作 |
预期现象与结论 |
相关离子方程式 |
| 取少量实验Ⅰ中的澄清溶液,加入试剂。 |
。 |
。 |
(15分)黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m 1 g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。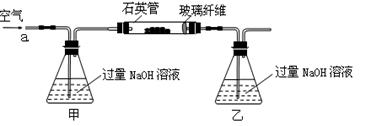
其反应的化学方程式为:4FeS2+11O2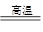 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS + 7O2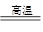 2Fe2O3+4SO2
2Fe2O3+4SO2
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理: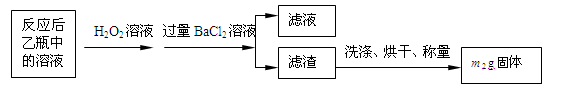
(1)鼓入空气的作用是________________________________________________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是(用化学方程式表示)_________。H2O2可以看作是一种很弱的酸,写出其电离方程式:。
(3)该黄铁矿石中硫元素的质量分数为(列出表达式即可)。
【实验二】测定铁元素的含量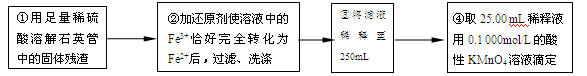
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
第四次 |
| 消耗KMnO4溶液体积/mL |
25.00 |
25.03 |
20.00 |
24.97 |
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______________。
(本题共11分)
某学习小组的同学对氯气与铁的反应及产物进行了如下探究: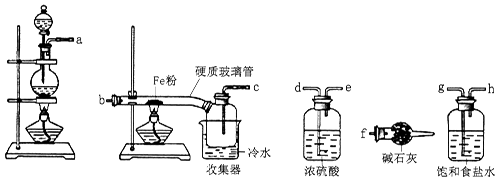
34.装置的连接顺序为a→→→→→b→c→f。
35.硬质玻璃管中可观察到的现象是。
硬质玻璃管与收集器之间没有用导管连接,原因是。
反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验: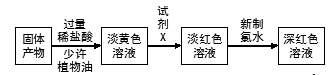
36.试剂X的化学式为;有同学分析淡黄色溶液中含有Fe2+,你认为(填“合理”或“不合理”);固体产物的成分可能为(填相应的字母);
| A.Fe和FeCl3 |
| B.FeCl2和FeCl3 |
| C.Fe、FeCl2和FeCl3 |
| D.Fe和FeCl2 |
37.加入少许植物油的作用是,用离子方程式表示加入新制氯水后溶液红色加深的原因。
38.某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因,
请设计实验对你所分析的原因进行验证,简要写出实验方案。