海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子形式存在。实验室从海藻中提取碘的流程如下:
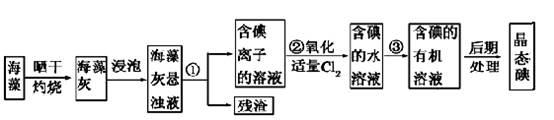
(1)指出提取碘的过程中有关实验操作的名称:
①为 ,③为 ;过程②中有关反应的离子方程式是 。
(2)提取碘的过程中可供选择的有机溶剂是( )
| A.甲苯、酒精 | B.四氯化碳、苯 |
| C.汽油、醋酸 | D.汽油、酒精 |
(3)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、 集气瓶、酒精灯、导管、圆底烧瓶、石棉网,以及必要的夹持装置、物品,尚缺少的玻璃仪器是 。
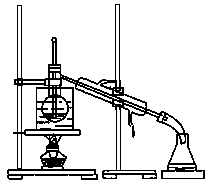
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏。指出下图所示的实验装置中的错误之处: ① ,② 。
(5)海藻灼烧时需要的主要仪器是 (填写仪器名称)
为研究A的组成与结构,某同学进行了如下实验:
| 实 验 步 骤 |
实 验 结 论 |
| (1)将9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过足量的浓硫酸和碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(1)A的实验式为 。 |
| (2)通过质谱法测得其相对分子质量为90。 |
(2)A的分子式为 。 |
| (3)另取9.0 g A,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)A中含有的官能团名称为 。 |
| (4)A的核磁共振氢谱有四组吸收峰,其峰面积之比为2︰2︰1︰1。 |
(4)综上所述,A的结构简式为 。 (5)写出A与NaHCO3反应的化学方程式 。 |
研究NO、NO2、SO2等大气污染气体的处理具有重要意义。
(1)以石灰石为原料通过系列反应将硫元素以CaSO4的形式固定,从而降低SO2的排放.但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4 (s)+CO (g)  CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2 (g)+CO2 (g)△H=218.4kJ·mol-1(反应Ⅰ)
CaSO4 (s) +4CO (g) CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
CaS(s) +4CO2(g)△H2=﹣175.6kJ·mol-1 (反应Ⅱ)
结合反应Ⅰ、Ⅱ写出CaSO4 (s)与CaS (s) 反应的热化学反应方程式 。
(2)NO2、SO2气体混合存在氧化物间的相互转化平衡:
NO2(g)+SO2(g) SO3(g)+NO(g),某活动小组对此反应进行研究实验
SO3(g)+NO(g),某活动小组对此反应进行研究实验
| 实验内容 |
实验现象 |
结论 |
|
| ① |
将充有NO2、SO2气体的密闭烧瓶放入热水中 |
气体红棕色加深,一段时间后颜色不再变化 |
△H 0(填“>”、“<”或“=”) |
② |
在针筒中抽入5mL NO2和5mL SO2气体,封闭针筒前端,充分反应后,将活塞迅速推至5mL处 |
气体红棕色加深并保持不变 |
平衡 (填“向左”、“向右”或“不”)移动 |
③ |
在充有NO2、SO2混合气体的恒容容器中,达平衡后继续通入SO2气体 |
平衡向右移动,SO2的转化率 (填“增大”、“减小”或“不变”) |
(3)工业上用活性炭还原法处理NO,有关反应为:C(s) +2NO(g) N2(g) +CO2(g)。
N2(g) +CO2(g)。
为了提高NO的转化率,下列的措施可行的是
A.再加入一定量的碳 B.增大压强
C.用碱液吸收气体 D.使用催化剂
(4)用间接电化学法除去NO的原理如图所示。已知电解池的阴极室中溶液呈酸性,阴极的电极反应式为 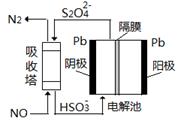
某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验: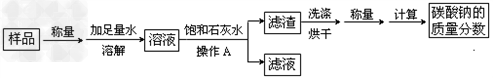
请回答下列问题:
(1)操作A用到的玻璃仪器除烧杯外还必需有 、 ;
(2)在实验过程中加入饱和石灰水后发生反应的离子方程式是
(3)为探究上述反应后滤液中的溶质成分,甲同学向滤液中滴加过量稀盐酸,发现无气泡产生,说明滤液中一定不含 (填溶质的化学式),若有气泡产生,那么测定的样品中碳酸钠的质量分数 (填偏大、偏小、无影响)
(4)在(3)探究中,滴加盐酸前滤液中的溶质除氯化钠外,一定还含有 (填化学式) ;
滴加盐酸的过程中一定发生反应的离子方程式为 。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由 色变为 色,并______为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是( )
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为________mL,终点读数为________mL,所用盐酸溶液的体积为________mL。
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.100 0 mol·L-1盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度。
根据下列实验装置回答:
(1)A中反应的化学方程式为_______________________;
(2)B中浓硫酸的作用是___________________________;
(3)C中的现象是____________________;化学方程式___________________;
(4)D的作用是 。
(5)E中收集的气体是_____________。