某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 |
预测现象 |
预测依据 |
实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
有白色 沉淀 |
Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 |
有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 |
无白色 沉淀 |
NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 |
有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1: ;实验2: 。
某实验小组用下列装置进行乙醇催化氧化的实验。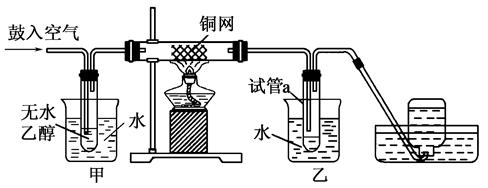
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式______________________________、_____________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明乙醇催化氧化反应是________反应。
(2)甲和乙两个水浴的作用不相同。甲的作用是________;乙的作用是___________________________________________。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是__________。集气瓶中收集到的气体的主要成分是________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______________________。要除去该物质,可先在混合液中加入________(填写字母)。
a.氯化钠溶液b.苯
c.碳酸氢钠溶液d.四氯化碳
然后,再通过________(填实验操作名称)即可除去。
为了测定乙醇的结构式是 ,利用乙醇和钠的反应,设计如图装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。
,利用乙醇和钠的反应,设计如图装置进行实验,在烧瓶中放入足量的钠,从分液漏斗中缓缓滴入一定量的乙醇,通过测量量筒中水的体积,就可知反应生成的氢气的体积。
(1)实验前检验该装置的气密性的实验操作是
__________________________________________________。
(2)有人认为装置中有空气,所测的气体体积应扣除装置中空气的体积,才是氢气的体积,你认为________(填“正确”或“不正确”)。
(3)如果实验开始前b导管内未充满水,则实验结果将________(填“偏大”或“偏小”)。
(4)若测得有1.15 g C2H6O参加反应,把量筒c中的水的体积换算成标准状况下H2的体积为280 mL,试结合计算和讨论,判断下面(Ⅰ)和(Ⅱ)两式中,哪个正确________。
实验室制取硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合液,加入反应器。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直到反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸和浓硝酸混合酸时,操作注意事项是__________________________________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是______________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是_________________________。
(5)纯硝基苯是无色、密度比水________(填“大”或“小”),具有________气味的油状液体。
苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):____________________________。
(2)B中NaOH溶液的作用是____________________。
(3)试管C中苯的作用是_______________________。
反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为____________(填反应类型)。
已知某种气态化石燃料含有碳和氢两种元素。为了
测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。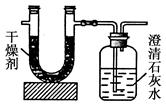
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1g |
102.9g |
| (石灰水+广口瓶)的质量 |
312.0g |
314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)气态化石燃料中碳元素与氢元素的质量比为________。