下列比较关系与排列顺序不正确的是
| A.酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| B.熔沸点:HF<HCl<HBr<HI |
| C.还原性:SiH4>NH3>H2O>HF |
| D.半径:Al3+<Mg2+<Na+<F- |
下表所列各组物质中,物质之间通过一步反应就能实现如右图所示转化的是( )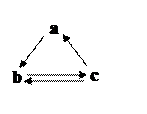
| a |
b |
c |
||
|
能够证明某分散系是胶体的方法是( )
| A.过滤 | B.观察颜色、状态 | C.利用丁达尔效应 | D.闻气味 |
若将NaOH(s)、P2O5(s)、无水CaCl2(s)归为一类。从A~D中选出一种最适宜与这三种物质归为一类的是( )
| A.浓硫酸 | B.氯化钠 | C.碱石灰 | D.生石灰 |
在地球上,一切生命活动都是起源于水的,下列有关水的物理量中,不随取水的体积变化而变化的是( )
| A.水的物质的量 | B.水的摩尔质量 | C.水的质量 | D.电解水所消耗的电量 |
将8克SO3加入X克水中,所形成的溶液里,SO42-和水分子个数比为1:5,则X等于()
| A.9克 | B.10.8克 | C.12.4克 | D.15.6克 |