实验室制备气体时,可根据反应物的状态、反应条件和生成气体的性质来选择气体的发生装置。
| 编号 |
A |
B |
C |
| 发 生 装 置 |
 |
 |
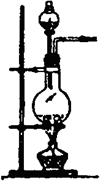 |
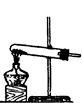
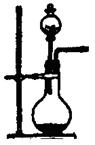
(1)实验室用氯酸钾和二氧化锰制氧气时,可选用的发生装置是 (写编号);
(2)实验室用食盐固体和浓硫酸制氯化氢气体时,可选用的发生装置是 (写编号),写出微热时的反应方程式 ;
(3)高锰酸钾和二氧化锰都是强氧化剂,均可将浓盐酸氧化为氯气。
(a) 用浓盐酸和高锰酸钾制氯气的反应方程式如下:
2KMnO4 + 16HCl 2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
2KCl + 2MnCl2 + 5Cl2 ↑ + 8H2O
①用“单线桥”在上述方程式上标出电子转移的方向和数目。
②反应中 元素被氧化, 是氧化剂。当有1mol电子转移时,可生成气体 升(标准状态下)。
(b) 用浓盐酸和二氧化锰制氯气的实验装置如图所示: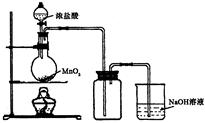
写出圆底烧瓶中发生反应的化学方程式_
②实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的化学方程式_________________________.
呋喃甲醇和呋喃甲酸是有机合成中的常用试剂,可用呋喃甲醛制备,其实验原理为: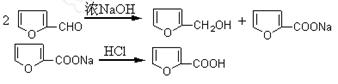
制备方法如下:①在50mL烧杯中放置3.28mL(0.04mol)呋喃甲醛,并用冰水冷却;称取1.6gNaOH溶于少量水中,在搅拌下滴加氢氧化钠水溶液于呋喃甲醛中。②在8~12℃下连续搅拌40min。③向反应混合物加入适量水使其恰好完全溶解,用乙醚萃取分液。④乙醚萃取物用无水硫酸镁干燥后,先在水浴中蒸去乙醚,然后蒸馏,收集169~172℃馏分得1.4g产品。⑤在乙醚提取后的水溶液中慢慢滴加浓盐酸到pH=3,搅拌,冷却,结晶,抽滤。⑥产物用少量冷水洗涤,抽干后,收集粗产物。再提纯后得精产品1.5g。
(1)本实验中,氢氧化钠必须溶于少量的水,否则水量过大主要会影响__________收率。
(2)本实验中要充分连续搅拌40min,其目的是______________________________。
(3)萃取时,用到的主要硅酸盐质的仪器是__________;抽滤的优点是______________________________________________________________________。
(4)呋喃甲酸粗产品提纯的方法是________________________________________。
(5)本实验中呋喃甲酸的产率为________________________________________ 。
盛极一时一种实验室常用的化学试剂,请按要求填空: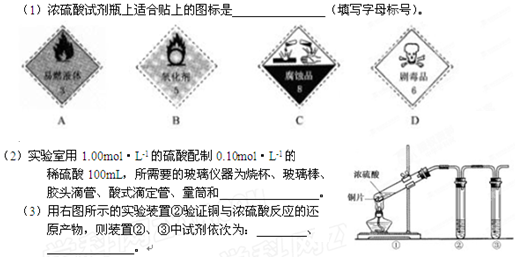
(4)装置①的反应方程式
若装置①中加入铜6.4克和含有0.2摩尔硫酸的浓硫酸产生二氧化硫
A等于6.4克 B 大于6.4克 C 小于6.4克 D不能确定
化学研究性学习小组拟通过实验探究“新制的还原性铁粉和过量盐酸反应生成FeCl2还是FeCl3”。请你参与探究并回答有关问题:
(1)一位同学用向反应后的溶液中滴加NaOH溶液的方法来验证溶液中含有Fe2+。①可观察到的实现现象是___________,②反应过程中发生反应的化学方程式是。
(2)另一位同学向反应后的溶液中先滴加KSCN溶液,再向其中滴加新制氯水,溶液呈现红色,但当滴加过量新制氯水时,却发现红色褪去。为了弄清溶液红色褪去的原因,同学们查到如下资料:
Ⅰ.铁有一种化合物称为铁酸盐(含有FeO42-)。
Ⅱ.SCN-的电子式为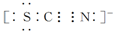
III.氯水具有很强的氧化性。
于是同学们提出两种假设:
①第一种假设是:Cl2可将Fe3+氧化为FeO42-,请写出该离子反应方程式__________。
②第二种假设是:____________,提出该假设的理论依据是___________________
晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如 下:
下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅。
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为 。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3 (沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):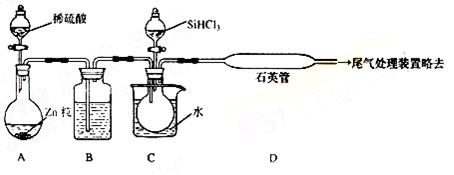
①装置B中的试剂是 ,装置C中 的烧瓶需要加热,其目的是: 。
的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生 反应的化学方程式为 。
反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量 铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水b.氯水 c.NaOH溶液d.KSCN溶液e.Na2SO3溶液
钢铁工业是国家工业的基础,是日常生活中用途最广、用量最大的金属材料。
(1)常温下,可用铁质容器盛装浓硫酸的原因是。
(2)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物。该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉。这种铁粉具有很高的反应活性,俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6mol/L盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。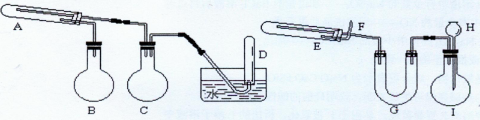
填写下列空白:
①实验进行时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是。
②实验时,U型管G中加入的试剂是;长颈漏斗H中应加入。
③试管E中发生反应的化学方程式是。
④为了安全,在E管中的反应发生前,在F出口处必须。