(1)把a、b、c、d 四块金属片浸入稀H2SO4中,分别用导线两两相连可以组成原电池。a、b相连时,导线上电子由 a→b;c、d相连时,电流由 d→c; a、 c相连时 c极上产生大量气泡; b、 d相连时,d极发生氧化反应。这4种金属的活动性由强到弱的顺序是_______________
(2)王同学想在钥匙上镀上一层铜,设计电解实验时,钥匙应和电源的 极相连。
(3)碳作阳极,铜作阴极电解MgCl2溶液的离子方程式:
碳作阴极,铜作阳极电解硫酸钠溶液的化学方程式:
(4)用惰性电极电解饱和食盐水,当电源供给0.2mol电子时,停止通电。若此时溶液体积为2L,则所得电解液的pH是 。(不考虑气体的溶解)
(5)将含有0.4mol Cu(NO3)2和0.4mol KCl的溶液1 L,用铂电极电解一段时间后,在一个极析出0.3mol红色物质,则另一个极上放出气体(标准状况下)为 L。
根据反应8NH3+3Cl2====6NH4Cl+N2回答下列问题。
(1)氧化剂_________,还原剂_________;
(2)反应中转移电子数是_________;
(3)氧化剂与氧化产物的质量比_________;
(4)当生成28gN2时,被氧化的物质的质量是_________g。
下列反应中氯元素全部被氧化的是____________,全部被还原的是____________,部分被氧化的是____________,既被氧化又被还原的是____________。
A.4HCl+MnO2 MnCl2+Cl2↑+H2O MnCl2+Cl2↑+H2O |
B.2NaCl 2Na+Cl2↑ 2Na+Cl2↑ |
| C.2KClO3====2KCl+3O2↑ | D.Cl2+H2O====HCl+HClO |
图所示的关系。
试回答下列问题:
(1)G的化学式为:。
(2)写出下列反应的化学方程式
①,
②。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质
的量与消耗盐酸的物质的量之比为3:8,则X的化学
式为:。
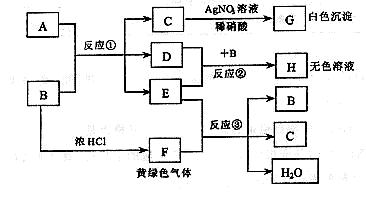
请回答:
(1) 依次写出A、B 中溶质的化学式:A_______ B________
(2) 依次写出反应①和②的离子方程式(H 中含有某+5价元素含氧酸根离子)
______________________________ ; ___________________________
(3) 写出反应③的化学方程式___________________________________

(1) ③号元素位于周期表第____周期第_____族,其单质的一种同素异形体能导电,该同素异形体的名称叫________
⑵④号元素形成的气态氢化物的电子式为__________,属于_____分子(填极性或非极性)
⑶⑥、⑦两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为_____________________________
⑷⑨号元素的原子结构示意图为_______________________。⑨与⑤两种元素形成的一种化合物是污染大气的主要有害物质之一,它对环境的危害主要是: