当前市售珍珠粉的价格从五元到上百元不等,但其外观、手感都没有明显差异。
那么优质珍珠粉和廉价珍珠粉的成分有何不同呢?就此问题,实验小组同学展开探究。
【查找资料】①优质珍珠粉直接由贝科动物体内珍珠加工而成,含有一定量的氨基酸、碳酸钙等。
②廉价珍珠粉由“贝壳粉”加工而成,贝壳加工过程中会用到氢氧化钠,贝壳的主要成分是碳酸钙。
③珍珠粉中除碳酸钙外,其它成分均不能与盐酸反应生成二氧化碳。
④氨基酸大部分能溶解于水,遇到浓硝酸并加热会呈现黄色或黑色。
⑤氯化钙溶液呈中性。
【提出猜想】优质珍珠粉和廉价珍珠粉的区别可能在于:①廉价珍珠粉含有 ;②廉价珍珠粉不含氨基酸;③碳酸钙含量不同。
【实验探究】
| 实验内容 |
现象 |
结论 |
| (1)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,静置一段时间后,滴加 。 |
廉价珍珠粉的上层清液变红,优质珍珠粉的溶液没有变色 |
猜想①成立 |
| (2)分别将少量优质珍珠粉和廉价珍珠粉放入试管中,加少量水,过滤, ,加热。 |
优质珍珠粉的溶液有黄色出现,局部变黑,廉价珍珠粉的溶液没有明显现象 |
猜想 成立 |
(3)分别将一定质量的优质珍珠粉和廉价珍珠粉放入烧杯中,再逐滴加入14.6%的稀盐酸,边滴加边振荡,直至恰好完全反应。数据记录如下:
| |
优质珍珠粉 |
廉价珍珠粉 |
| 珍珠粉的质量 |
100 g |
100 g |
| 加入盐酸的质量 |
460.0 g |
500.0 g |
| 烧杯中最终物质的总质量 |
520.0 g |
558.2 g |
①处理数据时,小明提出了如下思路:用加入盐酸的质量乘以盐酸的质量分数,求出反应的盐酸中的溶质质量,进而利用化学方程式求出珍珠粉中碳酸钙的质量。
你认为小明的思路是否可行,理由是 。
②处理数据后,得出结论:廉价珍珠粉中碳酸钙的质量分数为 %,含量高于优质珍珠粉。
【交流反思】通过探究和交流,同学们认为区分优质珍珠粉和廉价珍珠粉的最简便易行的方法是 。
.小雨阅读课外资料得知:双氧水分解除了用二氧化锰还可用氧化铜等物质作催化剂,于是她对氧化铜产生了探究兴趣.
【提出问题】氧化铜是否也能作氯酸钾分解的催化剂?它是否比二氧化锰催化效果更好?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列三组实验(其它可能影响实验的因素均忽略).
| 实验序号 |
KclO3质量 |
其他物质质量 |
待测数据 |
| ① |
1.2g |
/ |
_________ |
| ② |
1.2g |
CuO 0. 5g |
_________ |
| ③ |
1.2g |
MnO2 0.5g |
_________ |
(1)表中待测数据为 ,若实验②比实验①的“待测数据”更_________ (选填“大”或“小”),说明氧化铜能加快氯酸钾的分解速率;
(2)将实验②反应后的固体加水溶解、过滤、洗涤、干燥,若称量得到0.5g黑色粉末,再将黑色粉末放入试管中,____________(简述操作和现象)
【预期结论】氧化铜也可作氯酸钾分解的催化剂。
【评价设计】你认为小雨设汁实验③和实验②对比的目的是_________
【反思】(1)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证_________________。
(2)同种催化剂,还有哪些因素可能影响催化效果,请你再探究 (探究一种因素即可)。
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除MnO2、CuO外,Fe2O3也可以作KClO3分解的催化剂.
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 |
实验药品 |
分解温度 |
| ① |
KClO3 |
580℃ |
| ② |
KClO3、MnO2(质量比1:1) |
350℃ |
| ③ |
KClO3、CuO(质量比l:1) |
370℃ |
| ④ |
KClO3、Fe2O3(质量比1:1) |
390℃ |
【分析数据、得出结论】
(1)由实验______________与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是____________。
【反思】
(3)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和_____________不变;
(9分)科学探究是奇妙的过程,请你一起参与下列有关过氧化氢溶液制备氧气的探究实验。
(1)问题1过氧化氢溶液分解速率与催化剂种类有关吗?
在常温下,在相同质量、相同浓度的过氧化氢溶液中,分别加入1g二氧化锰和x g氧化铜,测量各生成一瓶(相同体积)氧气所需的时间。实验数据记录如下:
| 实验编号 |
Ⅰ |
Ⅱ |
| 反应物 |
5%过氧化氢溶液 |
5%过氧化氢溶液 |
| 催化剂 |
1 g 二氧化锰 |
x g 氧化铜 |
| 时 间 |
46 s |
84 s |
上述实验中可用排水法收集氧气,理由是 。实验Ⅰ反应的文字表达式是 ,若实验时忘了加入二氧化锰固体,结果是 。实验Ⅱ中x的值应为 。本实验中,与发生装置连接用来测量O2体积的装置可以用下图中的 (填编号)。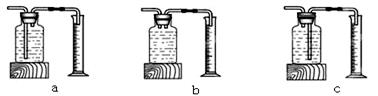
实验结论1: 。
(2)问题2过氧化氢溶液分解速率与反应物浓度有关吗?
实验数据记录如下:
| 双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2体积 |
|
| Ⅰ |
50.0g |
1% |
0.1g |
9mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31mL |
实验结论2:在相同条件下, 。
上述实验中除了量筒外还需用到的测量仪器有 (写出其中一种)。
(3)影响过氧化氢溶液分解速率可能还与温度有关,请设计实验方案进行验证: 。
下列是初中化学的两个实验,按要求回答问题:
(1)某课外活动小组设计测定空气中氧气含量的实验,实验装置如图所示: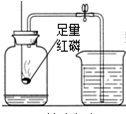
①红磷在集气瓶中发生反应的文字表达式为
该实验可观察到的现象为
该实验中红磷稍过量,目的是
②由实验现象可得出的结论是
(2)某课外活动小组设计如图装置研究分子的性质: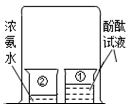
① 向盛有约20ml蒸馏水的小烧杯①中加入5~6滴酚酞溶液,搅拌均匀观察到溶液
② 从上述烧杯①中取少量溶液置于试管中,向其中慢慢滴加浓氨水,观察到溶液
③ 另取一个烧杯②(如图),加入约5ml浓氨水。用一个大烧杯罩住①②两个小烧杯。过了几分钟,观察到
综合②③实验说明分子
反思:为什么两个烧杯不同时变色呢?
查阅资料:不同的分子在相同的条件下运动速率不同。
由此可根据现象推断 分子运动速率快(填氨或酚酞)。
化学兴趣小组的三位同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。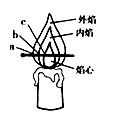
(1)贝贝取一支蜡烛,用小刀切下一小块,把它放入水中,蜡烛浮在水面上。结论:石蜡的密度比水_______;
(2)芳芳点燃蜡烛,观察到火焰分为外焰、内焰、焰心三层。把一根火柴梗放在火焰中(如上图所示)约1s后取出,可以看到火柴梗的________________(填“a”“b” 或“c”)处最先碳化。结论:蜡烛火焰的__________________温度最高;
(3)婷婷在探究蜡烛燃烧的过程中,发现罩在火焰上方的烧杯内壁被熏黑,你认为她的以下做法中不合适的是_________________。
| A.反复实验,并观察是否有相同现象 |
| B.查找资料,了解石蜡的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验目的无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色物质的原因 |
(4)三位同学在探究的过程中,将短玻璃导管插入焰心,发现另一端也可以点燃。
【提出问题】导管里一定有可燃性气体,气体成分可能会是什么呢?
【猜想】贝贝认为:可能是蜡烛不完全燃烧时产生的一氧化碳 (一氧化碳具有可燃性) 。
芳芳认为:可能是蜡烛受热后产生的石蜡蒸气。
婷婷认为:可能以上两种情况都有。
【实验方案】换一根较长的导管,并用冷的湿毛巾包住导管,然后在导管另一端做点火实验。
【现象与结论】
如果观察到 现象,则贝贝的猜想正确;
如果观察到 现象,则芳芳的猜想正确;
如果观察到 现象,则婷婷的猜想正确。