(9分)科学探究是奇妙的过程,请你一起参与下列有关过氧化氢溶液制备氧气的探究实验。
(1)问题1 过氧化氢溶液分解速率与催化剂种类有关吗?
在常温下,在相同质量、相同浓度的过氧化氢溶液中,分别加入1g二氧化锰和x g氧化铜,测量各生成一瓶(相同体积)氧气所需的时间。实验数据记录如下:
| 实验编号 |
Ⅰ |
Ⅱ |
| 反应物 |
5%过氧化氢溶液 |
5%过氧化氢溶液 |
| 催化剂 |
1 g 二氧化锰 |
x g 氧化铜 |
| 时 间 |
46 s |
84 s |
上述实验中可用排水法收集氧气,理由是 。实验Ⅰ反应的文字表达式是 ,若实验时忘了加入二氧化锰固体,结果是 。实验Ⅱ中x的值应为 。本实验中,与发生装置连接用来测量O2体积的装置可以用下图中的 (填编号)。
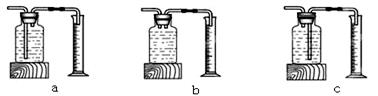
实验结论1: 。
(2)问题2 过氧化氢溶液分解速率与反应物浓度有关吗?
实验数据记录如下:
| |
双氧水的质量 |
双氧水的浓度 |
MnO2的质量 |
相同时间内产生O2体积 |
| Ⅰ |
50.0g |
1% |
0.1g |
9mL |
| Ⅱ |
50.0g |
2% |
0.1g |
16mL |
| Ⅲ |
50.0g |
4% |
0.1g |
31mL |
实验结论2:在相同条件下, 。
上述实验中除了量筒外还需用到的测量仪器有 (写出其中一种)。
(3)影响过氧化氢溶液分解速率可能还与温度有关,请设计实验方案进行验证: 。
小明同学欲通过实验证明“二氧化锰是氯酸钾受热分解的催化剂”这一命题,他设计并完成了下表所示的探究实验:
| 实验操作 |
实验现象 |
实验结论或总结 |
||
| 各步骤结论 |
总结 |
|||
| 实验一 |
将氯酸钾加热至熔化,伸入带火星的木条 |
木条复燃 |
氯酸钾受热分解能产生氧气,但是 。 |
二氧化锰是氯酸钾受热分解的催化剂 |
| 实验二 |
加热二氧化锰,伸入带火星的木条, |
木条不复燃 |
二氧化锰受热不产生氧气。 |
|
| 实验三 |
木条迅速复燃 |
二氧化锰能加快氯酸钾的分解速度。 |
(1)请你帮小明同学填写上表中未填完的空格;
(2)小英同学认为仅由上述实验还不能完全得出表内“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是;第二方面的实验是要。
某同学用下图装置测定空气中氧气的体积分数。请你填写有关空格,并与同学交流。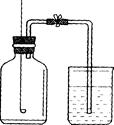
(1)该实验中,红磷需稍过量,目的是。该物质燃烧反应的文字表达式为____________________________。
(2)待该物质熄灭并冷却后,打开弹簧夹观察到的现象是___________;为什么要“待该物质熄灭并冷却后,打开弹簧夹”?
;
(3)实验后发现测定出的空气中氧气的体积分数小于l/5,这可能是由哪几种原因引起的?__________________________________________________________(写一点即可);
(4)某同学由本实验得到如下一些结论:①燃烧匙中的红磷越多,水位上升越高、②空气含有氮气、氧气、二氧化碳和稀有气体、③可用铁代替红磷完成该实验、④氮气难溶于水,其中正确的是:_______(填序号)。
某校化学研究性学习小组的同学对一瓶敞口放置的氢氧化钠产生了兴趣,甲乙两组同学围绕这瓶氢氧化钠进行了一系列的探究活动。
【提出问题】①氢氧化钠是否完全变质②样品中碳酸钠的质量分数是多少?
【查阅资料】①氢氧化钠与二氧化碳反应生成碳酸钠和水
②向氢氧化钠和碳酸钠混合物中加入盐酸时,盐酸先与氢氧化钠反应,再与碳酸钠反应;
【设计实验】实验一:探究氢氧化钠固体的变质情况
①取少量该固体样品置于试管中,向其中加入稀盐酸,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则反应方程式为。
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。请将下表填写完整。
| 实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
| 除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的氯化钙溶液, 充分反应后过滤 |
有关反应的化学方程式为 |
|
| 检验是否含有氢氧化钠 |
向过滤后的滤液中滴入 |
该样品中含有氢氧化钠 |
实验二:测定其中碳酸钠的质量分数
【设计方案】
①甲组同学:称取16.40g样品,放入过量的盐酸直到反应停止,共收集到4.40g二氧化碳。(设计思路:根据样品与盐酸反应生成二氧化碳的质量求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。)
②乙组同学:称取16.40g样品,加水配成溶液,向溶液中加入过量的澄清石灰水。过滤、洗涤、干燥,共得到白色沉淀10.00g。(设计思路:根据样品与石灰水反应生成沉淀碳酸钙的质量,先求出碳酸钠的质量,再计算样品中碳酸钠的质量分数。)
【解决问题】根据两组同学的实验结果,请你帮助他们计算出样品中碳酸钠的质量分数:_______。(任选一组数据进行计算,写出过程)
【交流与反思】
(1)在交流时,老师问同学们“能否用上述实验所得的数据计算出样品中氢氧化钠的质量分数”,甲乙两组的同学都一致认为可以。但小明思考后,觉得甲、乙两种方案都不妥,理由是:
小明又重新设计新方案:先用电子秤准确称取16.40g变质的NaOH样品放入锥形瓶中,用电子秤秤得锥形瓶及样品的总质量为51.40g,再把175.00g 7.3%稀盐酸平均分成7份依次加入样品中,每次充分反应用电子秤秤得锥形瓶及所盛物质的质量,实验数据记录如下:
| 加入盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
第六次 |
第七次 |
| 锥形瓶及所盛物质的总质量 |
76.40 |
101.40 |
126.40 |
151.40 |
174.20 |
197.00 |
222.00 |
(2)请根据上述实验数据,计算样品中氢氧化钠的质量分数为_________。(不要写出计算过程)
用来测定空气成分的方法很多,图1所示的是小明用红磷在空气中燃烧来测定氧气在空气中含量的方法,实验过程如下:

第一步:将集气瓶容积划分为五等份,并做好标记;
第二步:点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧;
第三步:待红磷熄灭并冷却后,打开弹簧夹,发现水进入集体瓶中,进入集体瓶中水的体积约为集气瓶原空气总体积的1/5。
请回答下列问题:
⑴上面的实验同时证明了氮气有_____________________________________的化学性质。
⑵实验完毕,若进入集气瓶中水的体积不到集气瓶中原空气总体积的1/5,你认为导致这一结果的原因可能是______________________________(写一条)。
⑶某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是:
__________________________________________________________________________
⑷写出红磷燃烧的文字表达式:________________________________________________
⑸上述实验中的红磷能否用木炭或硫代替_____(填“能”或“否”),原因是___________。
(7分)在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上附粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是,白色物质可能是Na2O或;
乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O + H2O = 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
| 实验操作 |
实验现象 |
结论 |
|
| 方案 1 |
取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质 为Na2O |
| 方案 2 |
取样品少量放入试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
白色物质 是 |
| 静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
【反思评价】丙同学认为方案1得到的结论不正确,理由是。
【得出结论】钠在二氧化碳中燃烧的化学方程式为。
通过以上探究,你还能获得哪些结论,请写出两条。(答对本小题将奖励4分,但全卷总分不超过60分)
⑴,
⑵。