下列有关物质性质叙述中正确的是
| A.氯气与水反应生成的次氯酸具有强氧化性,可用于漂白 |
| B.二氧化硅的化学性质很不活泼,不能与强碱反应生成盐 |
| C.通常状况下,干燥的氯气能和铁剧烈反应 |
| D.钠与硫酸铜溶液反应,可以置换出铜 |
A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是
A. 原子序数:A>B>C B. 原子半径:A>B>C
C. 离子半径:A2->B2+>C- D. 原子最外层电子数:A>C>B
下列说法不正确的是
① H2O2分子中既含极性键又含非极性键
②若R2—和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-稳定结构
⑤若X的质子数为a,中子数为b,则原子可表示为abX
⑥由于非金属性Cl>Br>I,所以酸性HCl>HBr>HI
⑦由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧原子序数为34号的元素属于长周期的副族元素
| A.②⑤⑥⑧ | B.①③④⑤ | C.②④⑤⑦ | D.③⑤⑦⑧ |
低合金高强度钢Q460是支撑“鸟巢”的铁骨钢筋,除含有铁元素外,还含有Mn(锰)、Ti(钛)、Cr(铬)、Nb(铌)等合金元素,下列有关说法正确的是
| A.Fe位于元素周期表的第四周期、第ⅧB族 |
| B.Q460比纯铁的硬度大 |
C.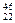 TiO2、 TiO2、 TiO2、 TiO2、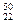 TiO2互为同位素 TiO2互为同位素 |
D.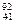 Nb3+原子核内有51个中子,核外有41个电子 Nb3+原子核内有51个中子,核外有41个电子 |
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关 X性质的描述中错误的是
| A.X单质不易与水反应 | B.XO2可被碳或氢气还原为X |
| C.XCl4的沸点比SiCl4的高 | D.XH4的稳定性比SiH4的高 |
下列叙述中,正确的是
| A.化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 |
| B.离子化合物中一定有金属元素 |
| C.蛋白质溶液、淀粉溶液和葡萄糖溶液都是胶体 |
| D.共价化合物中各原子都一定满足最外层8电子稳定结构 |