某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
①提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:催化剂中铁元素为+2价;
(1)假设3: 。
②设计实验方案。
③根据②的实验方案进行实验:
(2)步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是
;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
(3)步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设 成立;若出现血红色,则假设 成立;
(4)步骤4:另取A溶液于试管,加入KMnO4溶液,振荡,结合步骤3中的结论,若出现
现象,则假设1成立;反之,则假设3成立。
(5)某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论,该结论是否合理? (填“是”或“否”),理由是 。
(10分)已知芳香族化合物A、B、C、D的化学式均满足C8H8Ox,请按要求回答下列问题:
(1)A、B、C均为x=2的苯环上只有一个侧链的化合物,三者在碱性条件下可以发生如下反应:
A
 E(C7H6O2)+ F
E(C7H6O2)+ F
B
 M(C6H6O)+ J
M(C6H6O)+ J
C
 N(C7H8O)+ P
N(C7H8O)+ P
①写出C在NaOH溶液中反应的反应类型为,化学方程式。
②排列M、N、E三者的酸性强弱(用三者的中文名称表示)
(2)D为x=3的芳香族化合物,请写出一种有两个对位取代基,且能发生银镜反应的有机物的结构简式。
(3)当x=4时其中有一种化合物的结构简式为: 为实现以下物质的转化
为实现以下物质的转化
请用化学式填写下列空白处所需加入的适当试剂①②③。
(8分)现有七瓶无标签的液体,可能是①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄
糖溶液、⑦蔗糖溶液,现通过以下步骤来确定各试剂瓶中所装液体的名称。
| 实验步骤和方法 |
实验现象 |
| Ⅰ.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气体 |
只有F、G两种液体没有气味 |
| Ⅱ.各取少量于试管中加水稀释 |
只有C、D、E三种液体不溶解而浮在水上层 |
| Ⅲ.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 |
只有B使沉淀溶解,F中产生红色沉淀 |
| Ⅳ.各取C、D、E少量于试管中,加稀NaOH溶液并加热 |
只有C仍有分层现象,且在D的试管中闻到特殊香味 |
给部分试剂瓶重新贴上标签:
A、C、D、G 。
(10分)实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空: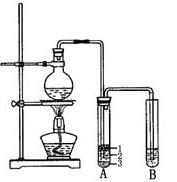
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸,加热时烧瓶中发生的主要化学反应为NaBr+H2SO4 = HBr+NaHSO4;HBr+CH3CH2OH CH3CH2Br+H2O实验中欲配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
CH3CH2Br+H2O实验中欲配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
a.天平b.量筒c.容量瓶 d.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。
试管A中的物质分为三层(如图所示),产物在第层。
(3)试管A中除了产物和水之外,还可能存在、(写出化学式)。
(4)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其杂质的正确方法是(填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:。
(14分)某化学小组设计如图装置完成一组实验:
(1)甲同学设计实验Ⅰ:查阅资料知,硅酸钠(Na2SiO3)溶液与较硅酸(H2SiO3)强的酸反应生成白色沉淀(H2SiO3)。A中装硝酸,B中装石灰石,C中装硅酸钠溶液。
①该实验目的:________________________________________
②预测实验现象:______________________________________
实验结论:____________________________________________
③乙同学分析甲同学设计的实验方案,认为该方案存在不足,请你分析乙同学的理由___________,提出修改建议:______________________________。
(2)丁同学设计方案Ⅲ:A中装硝酸,B中装石灰石,C中装漂白粉溶液,现象是C装置中产生白色沉淀。他得出酸性:HNO3>H2CO3>HClO。由此得出结论:元素非金属性:N>C>Cl。你认为得出的“结论”是否正确?________(填“正确”或“不正确”),理由是__________________________________。
动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:①,②,③,试管夹,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A—F) |
实验步骤②涉及方程式,实验步骤③涉及方程式。
(4)实验结论:。