为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,
其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,
内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: 。从装置的设计看,确定E中空气已被赶尽的实验现象是:______________。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明? 。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
据有关新闻报道,我国自2000年11月16日起,禁止使用含PPA的抗感冒药物。PPA是苯丙醇胺的英文缩写,其结构简式为: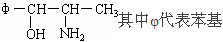
PPA能发汗驱寒,宣肺平喘,主要治疗伤风感冒哮喘、支气管炎等。但PPA能使中枢神经兴奋,导致不安、失眠。服用过量时可引起血压高或中风等。请回答下列问题:
(1)PPA(填“是”或“不是”)芳香烃,它的分子式为:。
(2)PPA可能具有的性质和可能发生的反应有(填序号)。
①酯化反应②消去反应③具有酸性④与Br2取代⑤加聚
(3)一个碳原子与四个不同原子或基团相连时,就称此碳原子为手性碳原子,如右图中中与溴相连的碳原子。则PPA分子内含有个手性碳原子。
(4)有机物A、B与PPA的分子式相同,A在一定条件下,可被氧化为苯丙氨酸。则A的结构简式为;
B可与FeCl3溶液起显色反应,试写出B的一种结构简式。
(5)已知:胺可以与NaNO2在催化剂作用下反应生成醇。如: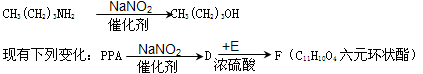
则E物质的名称为,F的结构式为。
写出D与E反应生成六元环状酯化合物的化学方程式:
。
现有A、B两种有机化合物,已知:
①它们的分子中含有相同数目的碳原子和氧原子,B可以看成A中一个氢原子被氨基取代得到;
②它们的分子中氢元素的质量分数相同,相对分子质量都不超过170,A中碳元素的质量分数为72.00%;
③它们都是一取代苯,分子中都没有甲基,都有一个羧基。
请按要求填空:
⑴A、B的分子中氢元素的质量分数都是___________;
⑵A的结构简式是________________________;
⑶A有一同分异构体C是对位二取代苯,能发生银镜反应也能与金属钠反应,但官能团不直接与苯环相连,C的结构简式是________________________;
⑷B有一同分异构体D是苯环上的一硝基化合物,其苯环和侧链上的一溴代物各有两种,D的结构简式是__________________________。
下图表示各物质之间的转化关系。已知:A、B、I都是XY2型化合物,且阳离子相同,A、B晶体中阴、阳离子个数比都是1∶1,但I晶体中阴、阳离子个数比是2∶1,I常用作干燥剂。
请按要求填空:
⑴G的电子式是_______________;
⑵反应⑥的化学方程式是__________________________________,反应⑤在空气中发生时的现象是________________________________,已知C的燃烧热是1300 kJ·mol-1,表示C的燃烧热的热化学方程式是________________________________________。
⑶根据上图中物质之间的转化关系及题中所给信息判断,B的化学式是_________。
近几十年发展起来的关于超重元素核稳定性理论认为:当原子核中质子和中子数目达到某一“幻数”(奇异的、有魔力的数)时,这个核将是特别稳定的。在周期表中铀以前的元素中具有2、8、20、28、50、82个质子或中子的核子是特别稳定的,中子数126也是一个重要的幻数。氦、氧、钙、铅的质子数和中子数都是幻数,具有这种双幻数的原子核更为稳定。科学家们用计算机算出下一个具有双幻数的元素将是含114个质子和184个中子的第114号元素X(称为超重元素)。若已知原子结构规律不发生变化,该元素X就是第周期第族元素,其最高氧化物的分子式为,再下一个具有双幻数的超重元素是质子数为164、中子数为318的164号元素Y,它应是第周期第族元素。
如图Ⅰ,在恒压密闭容器M中加入2 mol A和2 mol B,起始时容器体积为V L,发生如下反应并达到化学平衡状态:2 A(?)+B(?) x C(g);ΔH<0
x C(g);ΔH<0
平衡时A、B、C的物质的量之比为1∶3∶4,C的物质的量为 y mol。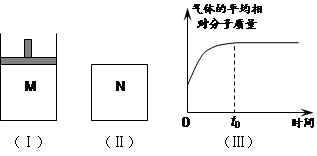
⑴根据题中数据计算,x =_________、y =_________;
⑵如图Ⅱ,在体积为V L的恒容密闭容器N中发生上述反应(其它条件相同),测得反应过程中气体的平均相对分子质量随时间的变化如图Ⅲ(t0时达平衡),平衡时容器中C的物质的量为z mol。由于反应物A、B的状态未知,则z和y的大小也不确定,请在下表中填入A、B的状态与z、y的大小之间的关系(仿照情形①、可不填满):
| 可能的情形 |
A、B是否为气态 |
z与y的大小关系 |
M(B)与M(C)的大小关系 (M表示摩尔质量) |
|
| A |
B |
|||
| ① |
是 |
不是 |
z =y |
不确定 |
| ② |
||||
| ③ |