反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
4NO(g)+6H2O(g)在10 L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v(X)(反应物的消耗速率或生成物的生成速率)可表示为
| A.v(NH3)=0.010 mol·(L·s)-1 | B.v(O2)=0.001 mol·(L·s)-1 |
| C.v(NO)=0.0010 mol·(L·s)-1 | D.v(H2O)=0.045 mol·(L·s)-1 |
设NA为阿伏加德罗常数的值,下列判断正确的是()
| A.含4molHCl的浓盐酸与足量MnO2混合加热,产生NA个Cl2 |
| B.标准状况下,22.4L己烷中共价键数为19NA |
| C.0.1mol Fe与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| D.氧气和臭氧组成的4.8g混合气体中含有0.3 NA个氧原子 |
下图所示的实验方法、装置或操作完全正确的是()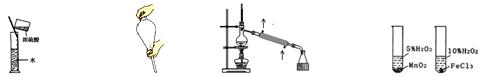
A.稀释浓H2SO4 B.萃取时振荡 C.石油的蒸馏
25℃时,水中存在电离平衡:H2O 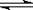 H++OH- ΔH>0。下列叙述正确的是()
H++OH- ΔH>0。下列叙述正确的是()
| A.将水加热,Kw增大,pH不变 |
| B.向水中加入少量NaHSO4固体,c(H+)增大,Kw不变 |
| C.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)降低 |
| D.向水中加入少量NH4Cl固体,平衡正向移动,c(OH-)增大 |
实验室从海带中提取碘的操作过程中,仪器选用不正确的是()
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如下图所示,下列叙述中正确的是
| A.MOH和ROH都是强碱 |
| B.在x点,c(M+)=c(R+) |
| C.稀释前,c(ROH)=10c(MOH) |
D.常温下,pH之和为14的 醋酸和ROH溶液等体积混合,所得溶液呈碱性 醋酸和ROH溶液等体积混合,所得溶液呈碱性 |