微生物燃料电池(MFC)是燃料电池中特殊的一类,它利用微生物作为反应主体.将有机物的化学能转化为电能。以葡萄糖溶液作底物为例,其工作原理如图所示。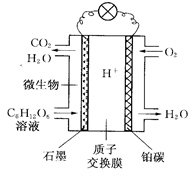
已知石墨电极上的反应为
C6H12O6+ 6H2O - 24e- ="====" 6CO2+ 24H+
(1)电池中的质子交换膜只允许质子和水分子通过。电池工作时,质子移向电池的_ __极(填正或负),铂碳上所发生的电极反应式为:___________ _ _______
(2)葡萄糖的燃烧热为2800 kJ·mol-1 ,写出葡萄糖完全燃烧的热化学方程式:_____________________________________________________________________
(3)化学需氧量(COD)是重要的水质指标.其数值表示将1L水中的有机物氧化为CO2、H2O所需消耗的氧气的质量。科学家设想利用微生物燃料电池来处理某些污水,并进行发电,该设想已经在实验室中获得成功。但如果1 L废水中有机物(折算成葡萄糖)氧化提供的化学能低于5.6 kJ,就没有发电的必要。则下列污水中,不适合用微生物燃料电池发电的是__________________(填序号)
| 序号 |
A |
B |
C |
D |
E |
| 污水类型 |
生活污水 |
印染 |
电镀 |
造纸 |
硫酸工业废水 |
| COD值/mg·L-1 |
520 |
870 |
20 |
960 |
120 |
获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: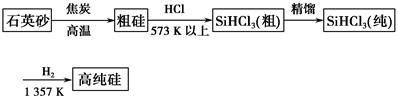
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl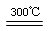 SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
某新型无机非金属材料A,由两种非金属元素组成,其中所含元素的化合价为其最高正价或最低负价,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。A可由化合物B经下列反应制得:①B+NH3→C[C的化学式为Si(NH2)4];②C经隔绝空气高温分解得到A。为探究B的组成,进行了下图所示的转化实验,图中G、F、H均为难溶于水的物质,且为白色粉末,图中字母代表的均为中学化学常见的物质。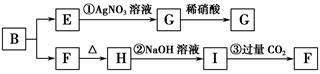
请回答下列问题:
(1)写出化合物B和化合物G的化学式________、________。
(2)A可能所属的晶体类型是________,在A晶体中,每个显正价原子周围结合的另一种原子的个数是________。
(3)写出反应②的离子方程式:_____________________________________________。
(4)写出C经隔绝空气高温分解得到A的化学方程式:_________________________________________________。
(5)分析反应③,你能得出的结论是________(合理即可)。
江苏省东海县矿产丰富,除了水晶制品名扬天下外,蛭石、蛇纹石等矿石储量大,品位高,其相关的耐火、保温隔热材料(主要成分为MgO、Al2O3)工业也较发达。某中学化学探究小组通过查阅相关资料,对蛭石的组成进行了实验探究。
Ⅰ.相关资料:①蛭石的成分可看成是由MgO、Fe2O3、Al2O3、SiO2组成;
②氢氧化物开始沉淀及沉淀完全时的pH:
| 氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
Al(OH)3 |
| 沉淀的pH范围 |
1.5~4.1 |
9.4~12.4 |
3.3~5.2 |
Ⅱ.相关实验: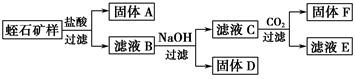
Ⅲ.实验数据:
①矿石样品质量为:8.22 g
②实验过程中得到固体的质量:A—2.40 g、D—2.14 g、F—1.56 g
③每次转化所得固体成分只有一种
请你根据以上内容和中学化学知识回答以下问题:
(1)过滤操作需要的玻璃仪器有:_____________________________________。
(2)写出由D制一种红色颜料的化学方程式:_____________________________________。
(3)工业上的耐火材料通常由F及滤液E进一步转化而成,请你根据滤液E中可能含有的成分,设计一个从滤液E制取耐火材料的实验方法:__________________________。
(4)滤液B与NaOH溶液反应时,应控制溶液的pH在7~8之间,这是因为_______________________________________________________。
(5)通过计算,写出用氧化物的形式表示蛭石组成的化学式:___________________________。
材料是人类生存和社会发展的物质基础,不同的材料功能各不相同。以下都是有关材料的内容,试根据所给内容回答问题。
(1)氢能是未来能源最佳选择之一,氢能的利用涉及氢的储存、输运和使用。贮氢合金是解决氢的储存等问题的重要材料。贮氢合金中最具代表的是镧镍合金(LaNi5),已知LaNi5(s)+3H2(g)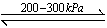 LaNi5H6(s)ΔH=-31.77 kJ·mol-1。
LaNi5H6(s)ΔH=-31.77 kJ·mol-1。
镧镍合金的熔点比镧、镍的熔点________(填“高”“低”或“介于两者之间”),根据反应原理,形成LaNi5H6的化学反应条件是________。最近有人提出可以研制出一种性能优越的催化剂,可以大大提高贮氢合金的贮氢能力,你认为该讲法可信吗?________(填“可信”或“不可信”),其理由是___________________________________________________。
(2)无机非金属材料是日常生活中不可缺少的物质,它往往具有高强度、耐高温、耐腐蚀的特点。Si3N4就是一种重要的精细陶瓷,合成氮化硅的方法之一为:
3SiO2+6C+2N2 Si3N4+6CO。Si3N4属于________晶体,在上述反应中氧化剂为________。
Si3N4+6CO。Si3N4属于________晶体,在上述反应中氧化剂为________。