某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有 (填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是 。
(3)第3步:氧化。操作是依次加入合适的试剂,其中下列氧化剂中最好选用 (填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是 。
(4)第4步:碘单质的检验。操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显 ,则证明海带中含碘。
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。请回答下列问题:
(1)装置A中发生的化学反应方程式为___________________________。
在此反应中,浓硫酸所体现的主要性质是______(填序号)
A酸性 B强氧化性 C脱水性 D吸水性 E强腐蚀性 F不挥发性
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是_____________,其作用是_________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是。
B中应放置的液体是(填字母)__________________。
a.水 b.酸性KMnO4溶液 c.浓溴水 d.饱和NaHSO3溶液
取wg含有杂质(杂质受热不分解)的NH4HCO3,选用如图所示的装置,制取一瓶干燥的氨气,多余氨气全部被水吸收。回答:
(1)选用的装置是(用A、B、C……回答),连接选取装置的正确顺序是(a,b,c……填写):接;接;接。
(2)E装置中所盛药品的名称是,其作用是。
(3)若选用B装置,连接时b口进气还是C口进气,其原因是。
(4)若收集到氨气VmL(标准状况),氨水的浓度为a mol/L,则碳酸氢铵的纯度为
%(设NH4HCO3全部分解)。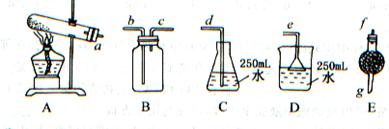
用一种试剂除去下列各气体中的杂质(括号内为杂质):
(1)CO2(SO2):试剂 ,离子方程式
(2)SO2(HCl):试剂 ,离子方程式
(14分)某研究性学习小组设计了如图所示的定量测定装置,其中B是底面积为100cm2、高20cm的圆筒状玻璃容器(带密封盖),上面标有以厘米为单位的刻度。其他夹持装置已略去。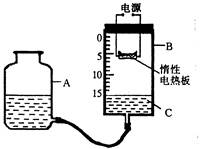
I.甲同学用这套装置测定出了空气中氧气的体积分数,他的操作过程是:
①检查装置的气密性;
②打开B容器密封盖,加入液体C,调整A的高度,使B中液面至刻度15.0cm处;
③将过量的铁粉平铺在电热板上,盖紧容器B的密封盖;
④通电加热铁粉,待充分反应后,冷却到原来的状况,调整A的高度使容器A、B中的液面保持水平,记录液面刻度。
请回答下列问题:
(1)在操作①中检查装置气密性的方法是__________________________ __。
(2)在该同学的实验中,下列物质不能用于代替铁粉的是______。
A.红磷 B.木炭 C.铜粉
(3)在操作④结束时,与装置B中的液面最接近的刻度是______cm(填整数)。
II.乙同学欲用此装置测定铁在氯气中燃烧产物的化学式。他的操作与甲不同之处有:将操作③中铁粉的质量改为1.0g,并使容器B充满氯气后,再盖紧容器。请回答下列问题:
(1)在乙同学的实验中,下列试剂中适合于做液体C的是_______。
A.水 B.氢氧化钠溶液 C.饱和食盐水
(2)实验结束时,液面在刻度8.8cm处。若将当时的实验条件近似看作标准状况,请据此计算生成物FeClx中x的值是______(计算结果保留1位小数)。
(3)上面的实验结果比理论值________(填“偏大”或“偏小”),误差产生的原因可能是____________________________________________________________。
(8分)著名化学家罗伯特·波义尔(Robert Boyle)在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过一会儿,他惊奇地发现,紫色的花瓣上出现了红点。波义尔对这一意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设?请将你的各种假设和验证假设的实验方案填写在下表中。