在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2⑧CCl4 ⑨C2H4 ⑩金刚石。用序号填空:
(1)只含有离子键的是______________________________________;
(2)既含有离子键,又含有极性共价键和配位键的是____________;
(3)既含有离子键又含有非极性共价键的是____________________;
(4)含有极性共价键和非极性共价键的非极性分子是____________;
(5)含有极性共价键和非极性共价键的极性分子是_______________;
(6)熔化时只破坏极性共价键的是_____________________________。
第三代混合动力车,可以用电动机、内燃机或二者结合推动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(1)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为:H2+2NiOOH 2Ni(OH)2
2Ni(OH)2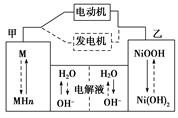
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH(填“增大”、“减小”或“不变”),该电极的电极反应式为。
(2)Cu2O是一种半导体材料,可通过如图的电解装置制取,电解总反应为:2Cu+H2O Cu2O+H2↑
Cu2O+H2↑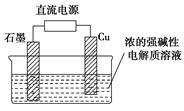
阴极的电极反应式是。
用镍氢电池作为电源进行电解,当蓄电池中有1 mol H2被消耗时,Cu2O的理论产量为g。
(3)远洋轮船的钢铁船体在海水中易发生电化学腐蚀中的腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的(填“正”或“负”)极相连。
近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
请回答下列问题:
(1)Pt(a)电极是电池的极,电极反应式为;Pt(b)电极发生反应(填“氧化”或“还原”),电极反应式为。
(2)电池的总反应方程式为。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有mol。
某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的正极是石墨(填“a”或“b”),发生反应。
(2)电池工作时,盐桥中的SO42-移向(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为:甲,乙。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为mol。
如图所示,在不同的电解质溶液中可以组成不同的电池。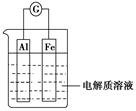
(1)①当电解质溶液为稀硫酸时,Fe电极是(填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是(填“正”或“负”)极,其电极反应式为。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是(填“正”或“负”)极,其电极反应式为。
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
Fe+2Fe3+=3Fe2+
2TiO2+(无色)+Fe+4H+=2Ti3+(紫色)+Fe2++2H2O
Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在范围。
(3)若把③中制得的固体TiO2·nH2O用酸清洗除去其中的杂质,还可制得钛白粉。已知25 ℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe(OH)3+3H+ Fe3++3H2O的平衡常数K=。
Fe3++3H2O的平衡常数K=。
(4)已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) ΔH=+140 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用方法。
| TiCl4 |
SiCl4 |
|
| 熔点/℃ |
-25.0 |
-68.6 |
| 沸点/℃ |
136.4 |
57.6 |