下图所示的电解池I和Ⅱ中,和均为电极。电解过程中,电极和上没有气体逸出,但质量均增大,且增重。符合上述实验结果的盐溶液是

| 选项 |
||
| A. |
||
| B. |
||
| C. |
||
| D. |
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g)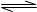 2C(g)经2分钟反应达到平衡,此时生成0.2mol C。
2C(g)经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是()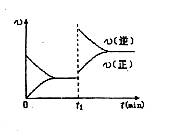
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
室温下,下列叙述正确的是(溶液体积变化忽略不计)()
| ① |
② |
③ |
④ |
|
| 溶液 |
氨水 |
氢氧化钠溶液 |
醋酸 |
盐酸 |
| pH |
11 |
11 |
3 |
3 |
A.分别将等体积的③和④加水稀释100倍,所得溶液的pH:③<④
B.在①、②中分别加入氯化铵固体,两溶液的pH均增大
C.①、④两溶液等体积混合,所得溶液中c(C1-)> c (NH )> c (OH一)> c (H+)
)> c (OH一)> c (H+)
D.②、③两溶液混合,若所得溶液的pH=7,则c (CH3COO一)> c (Na+)
用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为()
| A.0.5 mol/L | B.2 mol/L | C.l mol/L | D.无法确定 |
浓度都是0.1 mol·L-1的弱酸HX溶液与NaX溶液等体积混合后,在所得溶液中,有关离子浓度的关系错误的是()
| A.C(Na+)+C(H+)=C(X-)+C(OH-) |
| B.C(X-)+ C(HX)=2C(Na+) |
| C.若混合物呈酸性, 则C(X-)>C(Na+)>C(HX)>C(H+)>C(OH-) |
| D.若混合物呈碱性, 则C(Na+)>C(HX)>C(X-)>C(OH-)>C(H+) |
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮水处理的新技术。已知反应:()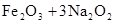

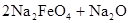 ,下列说法正确的是
,下列说法正确的是
| A.Na2O2既是氧化剂又是还原剂 |
| B.3 mol Na2O2发生反应,有12 mol电子转移 |
| C.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
| D.Na2FeO4既是氧化产物又是还原产物 |