硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种"金属"。这种"金属"可能是
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

| 发生的主要反应 |
|
| 电弧炉 |
 |
| 流化床反应器 |
 |
| 还原炉 |
 |
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为
②在流化床反应的产物中,大约占85%,还有、、等,有关物质的沸点数据如下表,提纯的主要工艺操作依次是沉降、冷凝和
| 物质 |
|||||||
| 沸点/℃ |
2355 |
57.6 |
31.8 |
8.2 |
-30.4 |
-84.9 |
-111.9 |
③极易水解,其完全水解的产物为
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3 的浓度为0.6mol·L-1,请回答下列问题:
的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为___________________________ __________
__________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“ >”.“<”或“=”)
>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)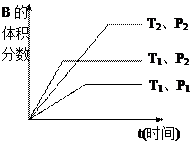
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体, 平衡 _____________移动。
平衡 _____________移动。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下: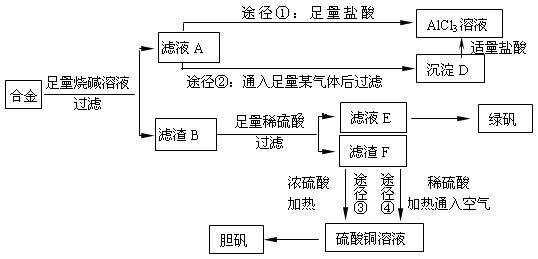
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的 是。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有和玻璃棒;其中玻璃棒的作用是。
是。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有和玻璃棒;其中玻璃棒的作用是。
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是、。
(4)通过途径 ④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、、冷却结晶、、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示)。
④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、、冷却结晶、、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示)。 (5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===C
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===C uSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是。
uSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是。
a.加热温度过高 b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却 d.所用坩埚事先未干燥(潮湿)
实 验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。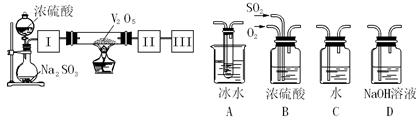
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ,装置Ⅱ,装置Ⅲ。
(3)开始进行实验时,首先应进行的操作是。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是(用含字母的代数表示)。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于 同主族。
同主族。
(1)X元素符号是
(2)Z、W形成的气态氢化物的稳定性 > (写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
。
(5)由X、Y、Z、W和Fe五种元素组成的 式量为392的化合物B,1
式量为392的化合物B,1  mol B中含有6mol结晶水。对化合物B进行如下实验:
mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过
一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a 、b 推知B溶液中含有的离子为;
②B的化学式为 。
10分)A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分反应中的H2O已略去)。请填空: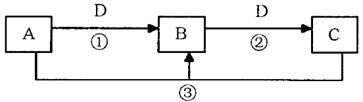
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是;工业上制取A的离子方程式为。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是。
(4)若D空气质量预报必报的气体,A、B、C的 的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是
的焰色反应都呈黄色,则可以证明B是否变质的一组试剂是 (请写出试剂名称)。
(请写出试剂名称)。