氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为,含少量 )为原料制备高纯氧化镁的实验流程如下:

(1)与稀硫酸反应的离子方程式为
(2)加入氧化时,发生反应的化学方程式为
(3)滤渣2 的成分是
(4)煅烧过程存在以下反应:
 ↑↑
↑↑
 ↑↑
↑↑
 ↑↑
↑↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①中收集的气体可以是
②中盛放的溶液可以是
a.溶液 b.溶液 c.稀硝酸 d.溶液
③中得到的淡黄色固体与热的溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
18.(9分) 按要求写热化学方程式:
(1) 已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式
___________________________________________________________________。
(2) 25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________________________________________________________。
(3) 已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g)ΔH2=-393.5 kJ/mol
③H2(g)+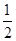 O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______________________________________.
17.(10分) 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l )的燃烧热 分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
分别为-285.8 kJ·mol-1 、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1) 用太阳能分解10 mol水消耗的能量是kJ;
(2) 甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为;
(3) 在容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃):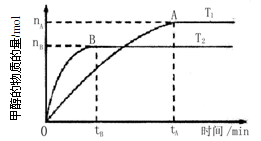
下列说法正确的是(填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)=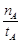 mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(4) 在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为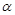 ,则容器内的压强与起始压强之比为.
,则容器内的压强与起始压强之比为.
16.下列反应在210℃时达到平衡:
①PCl5(g) PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
PCl3(g)+Cl2(g); △H1>0 K1=1mol·L—1
②CO(g)+Cl2(g) COCl2(g);△H1<0 K2=5×104L·mol—1
COCl2(g);△H1<0 K2=5×104L·mol—1
③COCl2(g) CO(g)+Cl2(g)
CO(g)+Cl2(g)
(1)反应③的平衡常数K3 =。
(2)要使反应①和反应②的K数值相等,可采取的措施是(填序号)。
| A.降低反应①、②体系中Cl2浓度 |
| B.反应①、②选择不同的催化剂 |
| C.反应①、反应②同时升高温度 |
| D.反应①、反应②同时降低温度 |
E.反应①降低温度,反应②维持210℃
15、(4分) 一定温度下,A、B两瓶乙酸的浓度分别是1 mol/L和0.1 mol/L,则A、B两瓶乙酸溶液中[ H+ ]之比10(填 “<”、“>”或“=”),并简述理由。
20.(12分)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOHb.Znc.Fed.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是_________ ___。若电解电路中通过2 mol电子,MnO2的理论产量为________g。