二氧化氯()是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产方法。
①用于电解的食盐水需先除去其中的、、等杂质。其次除杂操作时,往粗盐水中先加入过量的(填化学式),至沉淀不再产生后,再加入过量的和,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的,其原因是【已知:= 1.1 ×10-10 = 5.1 ×10-9】

②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠()与盐酸反应生成。
工艺中可以利用的单质有(填化学式),发生器中生成的化学方程式为。
(2)纤维素还原法制是一种新方法,其原理是:纤维素水解得到的最终产物与反应生成。完成反应的化学方程式:
+24+12=↑+↑+18+
(3)和均能将电镀废水中的氧化为无毒的物质,自身被还原为。处理含相同量得电镀废水,所需的物质的量是的倍
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第四周期第ⅠB 族。Cu2+的核外电子排布式为。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为。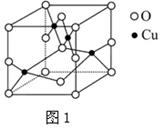
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图2:下列说法正确的是(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:。
(5)Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因:。
(6)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是________
(7)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下: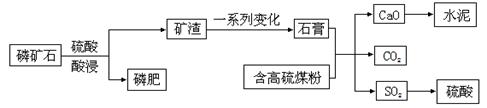
(1)将磷矿石制成磷肥的目的是,有关的化学方程式为。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是。
(3)水泥属于材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为,平衡常数K为。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a=,b=。
Ⅰ.在含有弱电解质的溶液中,往往有多个化学平衡共存。一定温度下,向1 L 0.l mol·L-1 CH3 COOH溶液中加入少量CH3COONa固体。
(1)CH3COOH溶液的电离平衡移动(填“向左”、“向右”或“不”),溶液中 (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若该溶液呈酸性,则溶液中各离子浓度由大到小的顺序为:。
Ⅱ、开发新能源和三废处理都是可持续发展的重要方面。
(1)H2、CO、CH3OH都是重要能源物质,它们燃烧热依次为285.8KJ/mol、281.5KJ/mol、726.7KJ/mol.已知CO、H2在一定条件下可以合成甲醇CO(g)+2H2(g)=CH3OH(l)。则该合成甲醇的热化学方程式为
(2)CO在催化剂作用下可以与H2反应生成甲醇:
CO(g)+2H2(g) CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)。在密闭容器中充入10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如图所示。
则M、N、Q三点的平衡常数KM、KN、KQ的大小关系为;P1P2(填“>”或“<”或“=”);
M、N两点平衡状态下,容器中物质的总物质的量之比为:n(M)总:n(N)总=。
(15分)某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如下: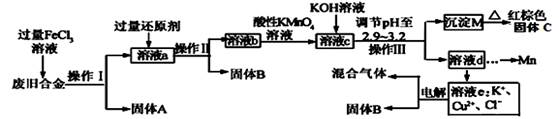
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是。
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是,溶液a中发生的反应的离子方程式为。
(3)若用x mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至。
(6)工业上由红棕色固体C制取相应单质常用的方法是。
A.电解法 B.热还原法 C.热分解法
(7)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为。
【化学—选修3:物质结构与性质】(15分)A、B、C、D、E、F均属前四周期且原子序数依次增大的六种元素,其中A、B、C是同一周期相邻的三种元素,C的氢化物水溶液呈碱性;D的基态原子3p轨道上有3个未成对电子;E、F为副族元素,4s能级均只有一个电子。回答下列问题:
(1)A、B、C三种元素按电负性由小到大的顺序是_________(用元素符号表示)。
(2)B与氧原子能形成四原子阴离子,其中B的杂化方式为_____________;C的三氯化物分子的立体构型为____________________________________。
(3)任写一种与BC—离子互为等电子体的离子__________________(写出化学式)。
(4)F原子的外围电子排布式为_____________,F晶体中原子的堆积方式是下图中的_________(填写“甲”、“乙”或“丙”)。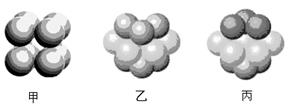
(5)E的离子可以形成多种配合物,将ECl3溶液蒸发浓缩,析出深绿色晶体。该晶体中E3+、Cl—、H2O的物质的量之比为1∶3∶6,且E的配位数为6。向1.0mol该晶体的溶液中加入足量AgNO3溶液产生143.5g白色沉淀,则该配合物的化学式为__________________________。
(6)AD是一种耐磨材料,其结构与金刚石相似,下图为其晶体结构单元,它可由A的三溴化物和D的三溴化物于高温下在氢气的氛围中合成。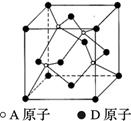
①写出合成AD的化学方程式:________________________。
②已知晶体中A与D原子的最近距离为a pm,则该晶体密度的表达式为_________g/cm3。(不需化简,阿伏加德罗常数为NA)