(选考)某磷肥厂利用某磷矿石[Ca3(PO4)2]制取磷肥并综合利用副产物生产水泥的工艺流程如下: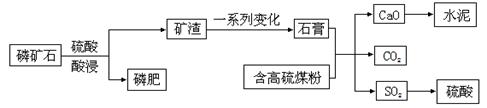
(1)将磷矿石制成磷肥的目的是 ,有关的化学方程式为 。
(2)在该工艺流程中高硫煤粉不需要脱硫,理由是 。
(3)水泥属于 材料。
(填“A”或者“B”:A.新型无机非金属材料 B.传统无机非金属材料)
(4)工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2mol SO2、1mol O2充入体积为2L的密闭容器中充分反应,放出热量98.3kJ,此时测得SO2的物质的量为1mol.则该热化学方程式为 ,平衡常数K为 。
(5)工业上用接触法制硫酸,最后的产品是98%的硫酸或组成为2H2SO4·SO3的发烟硫酸(H2SO4和H2SO4·SO3的混合物,其中SO3的质量分数约为29%)。若98%的浓硫酸可表示为SO3·aH2O,含SO329%的发烟硫酸可表示为bSO3·H2O,则a= ,b= 。
(12分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1) 写出该反应的化学平衡常数表达式K=______ ____。降低温度,该反应K值___ ___,二氧化硫转化率______,化学反应速率______。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是________。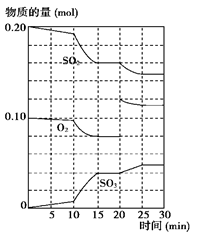
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ ___________________(用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)  2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?(填“是”或“否”)。此时,化学反应速率是v(正)v(逆)(填“>”、“<”或“=”),原因是。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态?(填“是”或“否”)。此时,化学反应速率是v(正)v(逆)(填“>”、“<”或“=”),原因是。
(8分)可逆反应 A(g) + 2B(g)  2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
2C(g) ΔH<0,在一定条件下达到平衡,若改变条件,将变化结果(“增大”、“减小”或“不变”)填入空格。
(1) 升高温度,B的转化率,v(正),v(逆)。
(2) 保持温度和压强不变,加入惰性气体,则C的物质的量,A的转化率。
(3) 保持温度和体积不变,加入惰性气体,A的转化率。
(4) 若温度和体积不变,反应从开始到平衡,容器内气体的密度,压强。
(11分)2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 molSO3(g)的ΔH=-99 kJ/mol。
请回答下列问题:
(1)图中A、C分别表示_____ ___、____ ____,E的大小对该反应的反应热有无影响?________.该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是_____________________________。
(2) 图中ΔH=_____ ___kJ/mol.
(3) V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化.写出该催化循环机理的化学方程式:_______________________
_______________________________________________。
(4)如果反应速率v(SO2)为0.05 mol/(L·min),则v(O2)=__________mol/(L·min)、v(SO3)=________ mol/(L·min).
(5) 已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO3(g)的ΔH=。
在同温同压下,同体积的CH4和CO2分子数之比为,物质的量之比为,原子总数之比为,质量之比为,密度之比为。
CO2的摩尔质量是;2molCO2的质量是;它在标准状况下所占的体积约为,所含的分子数目约为;所含氧原子的数目约为。