化学反应原理在科研和生产中有广泛应用
(1)利用"化学蒸气转移法"制备TaS2晶体,发生如下反应 (Ⅰ)反应(Ⅰ)的平衡常数表达式=,若=1,向某恒容密闭容器中加入1 和足量,的平衡转化率为,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为的一端放入未提纯的粉末和少量,一段时间后,在温度为的一端得到了纯净的晶体,则温度(填"﹥""﹤"或"=")。上述反应体系中循环使用的物质是。

(3)利用的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为 ,然后用一定浓度的溶液进行滴定,所用指示剂为,滴定反应的离子方程式为,
(4)25℃时,的电离常数,则该温度下的水解平衡常数=,若向溶液中加入少量的,则溶液中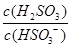 将(填"增大""减小"或"不变")。
将(填"增大""减小"或"不变")。
空气质量越来越爱到人们的关注,下表是部分城市某日的空气质量报告:
| 城市 |
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
| 北京 |
89 |
NOx |
Ⅱ |
良 |
| 上海 |
49 |
— |
Ⅰ |
优 |
| 宁波 |
55 |
SO2 |
Ⅱ |
良 |
| 克拉玛依 |
106 |
PM10 |
Ⅲ1 |
轻微污染 |
(1)由上表可知,在上述城市中,容易出现酸雨的城市有:;空气质量最差的成都市是:。
(2)可吸入颗粒(PM10)又称为飘尘,它与空气中的SO2、O2接触时,使部分的SO2转化为SO3,使空气酸度增加,形成酸雨。飘尘所起的主要作用是()。
A.氧化剂 B.还原剂 C.吸附剂 D.催化剂
(3) 汽车排放的尾气、硝酸和化肥厂等工厂排出的废气中都含有氮氧化物,氮氧化物溶于水最终转化为,这也是造成酸雨的另一个主要原因。
(4) 酸雨可导致下列哪种危害()
A.腐蚀建筑物 B.导致树木枯萎 C.造成洪涝灾害 D.影响湖泊生态环境
(5) 根据上表,请你提出改善北京空气质量的一项建议。
甲基苯丙胺俗称“冰毒”,是一种被严格查禁的毒品。已知甲基苯丙胺的相对分子质量小于150,氮元素的质量分数是10.37%,则其摩尔质量是。
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
回答下列问题:
⑴ 写出A的结构简式;⑵D分子中的官能团名称是;
⑶写出C的分子式;⑷ 写出反应④的化学方程式。
下列反应属于取代反应的是。
①CH2=CH2+HCl→CH3CH2Cl②Fe+2HCl=FeCl2+H2↑③CH4+Cl2 CH3Cl+HCl
CH3Cl+HCl
④ ⑤CH3COOH+CH3CH2OH
⑤CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5。0.9gC单质与足量盐酸作用放出标准状况时1.12L氢气,同时生成C的三氯化物。回答下列问题。
⑴A是______________,B是______________,C是______________。
⑵A、B、 C三种元素最高价氧化物对应的水化物酸性渐强碱性渐弱的顺序是(写化学式)
⑶A、B、C三种元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式。