既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应 ,在无水无氧条件下制备,实验装置示意图如下:
,在无水无氧条件下制备,实验装置示意图如下:

有关物质性质如下表
| 物质 |
熔点/℃ |
沸点/℃ |
其他 |
| -23 |
76 |
与互溶 |
|
| -25 |
136 |
遇潮湿空气产生白雾 |
仪器的名称是,装置中的试剂是。反应开始前依次进行如下操作:组装仪器、、加装药品、通一段时间后点燃酒精灯。反应结束后的操作包括:①停止通②熄灭酒精灯 ③冷却至室温。正确的顺序为(填序号)。欲分离中的液态混合物,所采用操作的名称是。
(2)工业上由钛铁矿()(含、等杂质)制备的有关反应包括:
酸溶
水解
简要工艺流程如下:

①试剂为。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是。
②取少量酸洗后的,加入盐酸并振荡,滴加溶液后无明显现象,再加后出现微红色,说明中存在的杂质离子是。这种即使用水充分洗涤,煅烧后获得的也会发黄,发黄的杂质是(填化学式)。
某化学兴趣小组需100mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为A→B→__________(填字母).
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
Ⅱ.标定FeSO4溶液的浓度
(1)用滴定管量取20.00mL FeSO4溶液放入锥形瓶中,用0.10mol•L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00mL,若生成物中Mn元素全部呈+2价,据此可测得FeSO4溶液的物质的量浓度为______mol•L-1.
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,理由是__________.
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
3.48 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.32 |
158 |
| 氯化钠 |
0.08 |
58.5 |
(1)下列“鲜花保鲜剂”的成分中,属于电解质的是_____________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图。则烧杯的实际质量为______________g。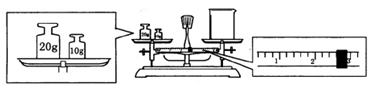
(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、______________。(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为____________________。
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度为__________mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为__________(填化学式)。
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:_________.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
按以下装置图进行实验,填写有关现象及化学方程式。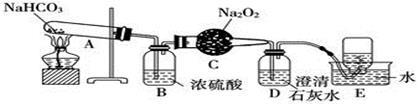
(1)A中现象是____________________;
(2)B中浓硫酸的作用是_______________;
(3)C中发生反应的化学方程式为 ;
(4)D中现象是______ ,反应的离子方程式是_________________ ;
(5)E中收集的气体是____________。
请用如下图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置。(提示:Cl2可与KI反应生成I2,淀粉遇I2变蓝)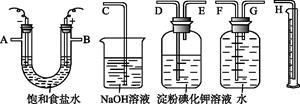
(1)所选仪器连接时,各接口的顺序是(填各接口的字母代号):A接 、 接 ;B接 、 接 。
(2)证明产物Cl2的实验现象是 。
(3)实验测得产生的氢气体积(已折算成标准状况)为5.60 mL,电解后溶液的体积恰好为50.0 mL,则溶液中NaOH的物质的量浓度 。
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯②100 mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,不需要使用的仪器和用品有____________(填序号),还缺少的仪器是 。
(2)下列操作会使配制的溶液浓度偏低的是 (填字母)
A.没有将洗涤液转移到容量瓶B.转移过程中有少量溶液溅出
C.容量瓶洗净后未干燥 D.定容时俯视刻度线
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.容量瓶用蒸馏水洗净后,再用碱液润洗
B.使用容量瓶前检查它是否漏水
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列实验操作步骤的正确顺序是(填序号,不能重复) ;
①用托盘天平称量10g NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把恢复室温的溶液小心地转入500mL容量瓶中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(5)实验中还需要2mol/L的NaOH溶液850mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是 (填序号)
A.1000mL,80g B.950mL,76g C.任意规格,72gD.500mL,42g