实验室用固体NaOH配制0.5 mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100 mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,不需要使用的仪器和用品有____________(填序号),还缺少的仪器是 。
(2)下列操作会使配制的溶液浓度偏低的是 (填字母)
A.没有将洗涤液转移到容量瓶 B.转移过程中有少量溶液溅出
C.容量瓶洗净后未干燥 D.定容时俯视刻度线
(3)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.容量瓶用蒸馏水洗净后,再用碱液润洗
B.使用容量瓶前检查它是否漏水
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列实验操作步骤的正确顺序是(填序号,不能重复) ;
①用托盘天平称量10g NaOH固体放入小烧杯中,加适量蒸馏水溶解;
②继续向容量瓶中加蒸馏水至液面距刻度线1-2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面的最低处与刻度线相切;
③把恢复室温的溶液小心地转入500mL容量瓶中;
④将容量瓶塞紧,充分摇匀;
⑤用少量蒸馏水洗涤烧杯与玻璃棒2-3次,洗涤液一并转移到容量瓶中。
(5)实验中还需要2mol/L的NaOH溶液850mL,配制时应选用的容量瓶的规格和称取NaOH的质量分别是 (填序号)
A.1000mL,80g B.950mL,76g C.任意规格,72g D.500mL,42g
在众多的新能源中,氢能将会成为21世纪最理想的能源。
Ⅰ. 已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如下:
| 物质 |
氢气 |
原煤 (主要成份是C) |
汽油 (主要成份C8H18) |
| 热量(kJ) |
285.8 |
250.9 |
4910 |
(1)H2燃烧的热化学方程式是_____________________。
(2)H2可以代替原煤和汽油作为新能源的依据是_____________________。
(3)工业上电解饱和食盐水的副产物之一是H2,反应的离子方程式是_____________。
Ⅱ. 如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。
请回答:
(1)该过程可循环利用的物质是_______________(写化学式)。
(2)该过程总反应的化学方程式是_____________________。
(3)尾气中的SO2可用NaOH溶液吸收,同时可得含Na2SO3的样品,为测定样品中Na2SO3的质量分数,甲同学设计实验如下(夹持及加热装置略):
① 装置B的作用是 。
② 测定样品中Na2SO3的质量分数所需的数据是 。
实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
【查阅资料】Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;K2FeO4易溶于水、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
【制备KClO及K2FeO4】
(1)仪器a的名称: ,装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/LKOH溶液中,② ,③ ,
④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥。
【测定产品纯度】
(5)称取提纯后的K2FeO4样品0.2100 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42-==Fe(OH)3↓+CrO42-+OH-,Cr2O42-+6Fe2++14H+==6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为 。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
① 将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
② 将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
③ 向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④ 重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从___________色变为___________色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察___________;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是______________________,由此造成的测定结果____________ (填偏高、偏低或无影响);
(4)步骤②缺少的操作是__________________;
(5)右图,是某次滴定时的滴定管中的液面,其读数为__________mL;
(6)根据下列数据:
| 滴定次数[ |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
25.00 |
0.50 |
20.40 |
| 第二次 |
25.00 |
4.00 |
24.10 |
请计算待测烧碱溶液的浓度为___________mol/L
某同学利用下图装置可探究浓硫酸与木炭粉在加热条件下反应产生的三种气体产物,请填写下列空白: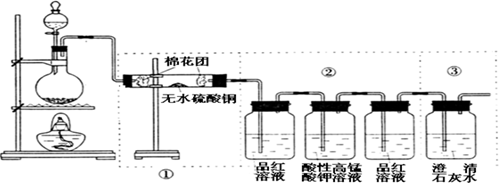
(1)写出木炭粉与浓硫酸反应的化学方程式___________________________。
(2)无水硫酸铜的作用是____________,②中3个洗气瓶的作用依次为____________ 、____________、____________;
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.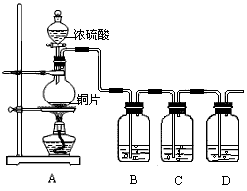
请回答下列问题.
(1)某同学拧开分液漏斗下面的活塞后发现开始时能流出,但一会就停止了,情分析原因:___________________。
(2)铜和浓硫酸反应的化学方程式为__________________________。
(3)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有__________(填选项的字母,下同), C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有_______________.
A.氧化性 B.还原性 C.漂白性
(4)D瓶中盛有NaOH溶液,作用是______________.