卤族元素包括等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是。

(2)利用"卤化硼法"可合成含和两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有原子的个数为,该功能陶瓷的化学式为。

(3)和中心原子的杂化方式分别为和。第一电离能介于、之间的第二周期元素有种。
(4)若与通过原子与原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是。
(8分)如图转化关系中已知A是Na2O2,甲是气体,B、F两种气体都能使澄清石灰水变浑浊。F气体使品红溶液褪色,加热又恢复原色, H是一种强酸;丙是一种金属单质。(部分反应物或产物略去)
(1)写出下列物质的化学式:甲_______ D_______G________
(2)写出下列反应的化学方程式:
A与B __________________________________
H→F ___________________________________
(3)丙投入浓H溶液中,无明显变化,原因是______________。
(8分)(1)填空:
A、硅原子结构示意图______B、水晶化学成分_______
(2) 如图装置,能制取并收集到NO,稀硝酸与铜反应的化学方程式_______________________,反应中还原剂与氧化剂的物质的量比是____________
(3) 从集气瓶中的气体并不能证明一定浓度的硝酸与铜反应的产物只有NO。用化学方程式说明原理__________ ____________
____________
(8分)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)工业上将X 气体通入石灰乳
气体通入石灰乳 [Ca(OH)2]制取漂白粉,X是。
[Ca(OH)2]制取漂白粉,X是。
(2)将少量漂白粉溶于一定量的水中,得到无色溶液A。
①再取少许溶液A,滴加几滴酚酞溶液,溶液呈红色,随后溶液迅速褪色,说明该溶液呈__________性并具有__________性。
②另取少量溶液A,滴加_________溶液和_________溶液,有白色沉淀,即能检验其中的Cl—。
③取少量溶液A,滴入Na2CO3溶液,生成白色沉淀,该离子反应方程式为______________。
同温同压下,质量相同的五种气体:①H2②O2③CH4
所占的体积由大到小的顺序是(填序号,下同)____ _____________;
_____________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
苏合香醇可以用作食用香精,其结构简式如图17所示。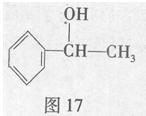
(1)苏合香醇的分子式为,它不能发生的有机反应类型有(填数字序号)。
①取代反应②加成反应③消去反应
③加聚反应⑤氧化反应⑥水解反应
有机物丙是一种香料,其合成路线如图18。其中甲的相对分子质量通过质谱法测得为88,它的核磁共振氢谱显示只有三组峰乙;乙与苏合香醇互为同系物。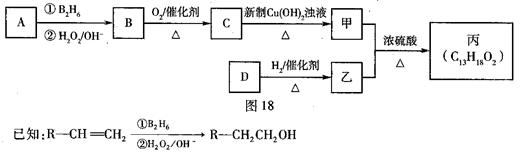
(2)按照系统命名法,A的名称是。
(3)C与新制Cu(OH)2悬浊液反应的化学方程式为。
(4)丙中含有两个—CH3在催化剂存在下1 mol D与2 mol H2反应可以生成乙,D可以发生银镜反应,则D的结构简式为。
(5)甲与乙反应的化学方程式为。
(6)苯环上有3个取代基或官能团,且显弱酸性的乙的同分异构体共有____种,其中3个取代基或官能团互不相邻的有机物结构简式为____。