聚酰胺-66常用于生产帐篷、渔网、降落伞及弹力丝袜等织物,可利用下列路线合成:

已知反应:
(1)能与银氨溶液反应的B的同分异构体的结构简式为
(2)的结构简式为
(3)为检验中的官能团,所用试剂包括NaOH水溶液及
(4)由和生成H的反应方程式为
。
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的化学方程式并用双线桥法在化学方程式上标出电子转移的方向和总数____________________。
(2)取300mL0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式_________________________________。
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能___________(填“失去”或“得到”)_________mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
“8·12”天津港危化仓库爆炸,造成生命、财产的特大损失。据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN)。请回答下列问题:
(1)钠、钾着火,下列可用来灭火的是 。
A.水 B.泡沫灭火器 C.干粉灭火器 D.细沙盖灭
(2)NH4NO3为爆炸物,在不同温度下加热分解,可能发生非氧化还原反应,
可能发生氧化还原反应,下列反应可能发生的是 。
A.NH4NO3 → N2 + O2 + H2O
B.NH4NO3 → NH3 + HNO3
C.NH4NO3 → O2 + HNO3 + H2O
D.NH4NO3→ N2 + HNO3 +H2O
E.NH4NO3→N2+ NH3+ H2O
F.NH4NO3 →N2O + H2O
(3)NaCN属于剧毒物质,有多种无害化处理方法。
①H2O2处理法:NaCN + H2O2 —— N2↑+ X + H2O推测X的化学式为 。
② NaClO处理法:aCN-+bClO-+2cOH-= dCNO-+eN2↑+fCO32-+bCl-+cH2O
方程式中e : f的值为 (填选项标号)。
A.1B.1/2 C.2D.不能确定
(4)以TiO2为催化剂用NaClO将CN-离子氧化成CNO-,CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L—1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:______________;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为 。
W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示: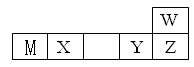
其中只有M为金属元素,请回答下列问题:
(1)M在元素周期表中的位置为 ,比较Y与Z两种元素的简单离子的半径大小 (用离子符号表示)。
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式 。
(3)科学家研制出一种新型分子C16Y8(结构如图所示)
它将成为潜在的储氢材料。1molC16Y8最多能与 molH2发生加成反应。
(4)一种名贵黄石组成为M2(XO4)WOH,在强碱性溶液中会发生腐蚀,写出其过量NaOH溶液反应的化学方程式 。
Cl2及其化合物在生产、生活中具有广泛的用途。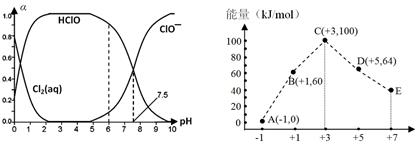
(1)25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
①已知HClO的杀菌能力比ClO-强,由图分析,用氯气处理饮用水时,pH=7.5与 pH=6时杀菌效果强的是________________;
②氯气-氯水体系中,存在多个含氯元素的平衡关系,分别用平衡方程式表示为_________________________。
(2)①ClO2是一种新的消毒剂,工业上可用Cl2氧化NaClO2溶液制取ClO2,写出该反应的化学方程式________ ;
②工业上还可用下列方法制备ClO2,在80℃时电解氯化钠溶液得到NaClO3,然后与盐酸反应得到ClO2。电解时,生成ClO3–的电极反应式为_________________ ___。
(3)一定条件下,在水溶液中 1 mol Cl–、1mol ClOx–(x=1,2,3,4)的能量大小与化合价的关系如图所示
①从能量角度看,C、D、E中最不稳定的离子是 (填离子符号);
②B → A + D反应的热化学方程式为 (用离子符号表示)。