W、M、X、Y、Z五种短周期元素在周期表中的位置如图所示:
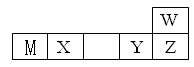
其中只有M为金属元素,请回答下列问题:
(1)M在元素周期表中的位置为 ,比较Y与Z两种元素的简单离子的半径大小 (用离子符号表示)。
(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式 。
(3)科学家研制出一种新型分子C16Y8(结构如图所示)

它将成为潜在的储氢材料。1molC16Y8最多能与 molH2发生加成反应。
(4)一种名贵黄石组成为M2(XO4)WOH,在强碱性溶液中会发生腐蚀,写出其过量NaOH溶液反应的化学方程式 。
对于反应:A+B→C+D+H2O,若已知A是硫酸盐,C是不溶于盐酸的白色沉淀,D是能使湿润的红色石蕊试纸变蓝的气体。请回答:
(1)C属于,D属于。(填字母)
A、电解质 B、非电解质 C、胶体 D、本身能导电的物质
(2)B属于 ______。(填字母)
A、单质 B、酸 C、碱 D、 盐
盐
(3)该反应(填“是”或“不是”)氧化还原反应。
(4)写出A的电离方程式: _____ _。
(5)写出该反应的化学方程式:___。
实验室用固体NaOH配制0.5 mol/L的NaOH溶液500 mL,有以下仪器和用品有:①烧杯 ②100 mL量筒 ③容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,没有使用的仪器和用品有____________(填序号),还缺少的仪器是。
(2)在配制的转移过程中某学生进行如右图操作,请指出其中的错误:、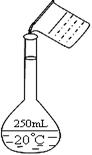
(3)下列操作会使配制的溶液浓度偏低的是(填字母)
A、没有将洗涤液转移到容量瓶 B、转移过程中有少量溶液溅出
C、容量瓶洗净后未干燥 D、定容时俯视刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用碱液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(5)实验中还需要2mol/L的NaOH溶液950mL,配制时应选用的容量瓶的规格和称取 NaOH的质量分别是(填序号)
NaOH的质量分别是(填序号)
A.1000mL,80g B.950mL,76g C.任意规格,72g D.500mL,42g
(1)用于金属焊接的某种焊条,其药皮由大理石(CaCO3)、水泥、硅、铁等配制而成。
①Al的原子结构示意图为_____________________;
②30Si的原子的中子数为_________;
③可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(填序号)
除去石灰水中悬浮的大理 石颗粒。
石颗粒。
(2).根据下图所示,并选择适宜的物质可以完成图中各步转化推断物质X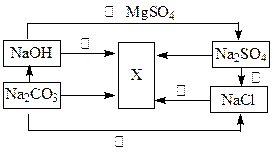
则X的化学式:。
下图表示常见元素单质及化合物相应关系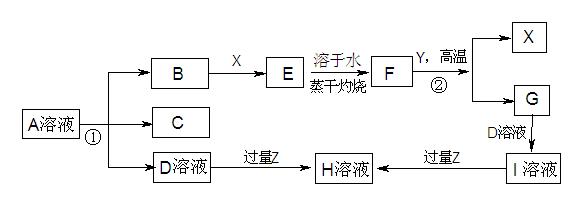
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分
请回答下列问题:
(1)D的电子式;H为(填化学式)
(2)完成下列方程式
空气中含量最高的气体与C反应的化学反应方程式
反应②的化学 反应方程式
反应方程式
足量B通入H溶液的离子反应方程式
(1)如下图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是________________。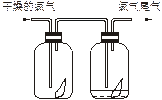
 (2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
(2)实验室为防止氯气尾气污染空气,根据氯水显酸性的性质,可用_____________溶液吸收多余的氯气。
工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是___________(均填化学式),
长期露置于空气中的漂白粉,加稀盐酸后产生的气体是___________(用字母代号填)。
A.O2 B.Cl2 C.CO2 D.HClO
(3)当氯气泄漏人们逃离现场时,可以用浸有一定浓度的某种物质的水溶液 的毛巾捂住鼻子,最适宜采用的该物质是_______。
的毛巾捂住鼻子,最适宜采用的该物质是_______。
A.NaOH B.NaCl C.KBr D.Na2CO3
(4)氯气和二氧化硫都有毒,但将两者等物质的量混合通入水中毒性会消失,用离子方程式表示毒性消失的原因