某市对大气进行监测,发现该市首要污染物为可吸入颗粒物(直径小于等于2.5的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对、、等进行研究具有重要意义。请回答下列问题:
(1)对样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 |
||||||
| 浓度/ | 4×10-6 |
6×10-6 |
2×10-5 |
4×10-5 |
3×10-5 |
2×10-5 |
根据表中数据判断的酸碱性为,试样的值。
(2)为减少的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含的烟气,以下物质可作洗涤剂的是;
a. b. c. d.
(3)汽车尾气中和的生成及转化为:
①已知气缸中生成的反应为: 
若1空气含有0.8和0.2,1300℃时在密闭容器内反应达到平衡。测得为8×10-4.计算该温度下的平衡常数K=;汽车启动后,气缸温度越高,单位时间内排放量越大,原因是。
②汽车燃油不完全燃烧时产生,有人设想按下列反应除去:
已知该反应的,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少和的污染,其化学反应方程式为 。
化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g) 4C(g)
4C(g)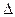 H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B
H >0达到平衡时,c(A)="2mol/L," c(B)="7mol/L," c(C)=4mol/L。试确定B 的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
的起始浓度c(B)的取值范围是;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是
①增加C的物质的量②加压③升温④使用催化剂
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是(填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1m2(选填“<”、“=”、“>”)
阅读下面两条科普信息,回答问题:①一个体重为50kg的健康人含铁2g,这2g铁在人体中不是以单质金属的形 式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血病人补铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。②在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿;该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)
(1)这两则科普信息分别介绍了人体内和海水中亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明亚铁离子具有性,铁离子具有性。
(2)①中的维生素C是剂。②中的CO2是剂,CH2O是产物。
(3)已知含Fe3+的盐可用于净水,因为水解生成的氢氧化铁胶体具有吸附性,写出实验室制备氢氧化铁胶体的离子方程式
有一包白色固体粉末,其中可能含有NaCl、BaCl2、Cu (NO3)2、Na2CO3中的。一种或几种,现做以下实验:
(NO3)2、Na2CO3中的。一种或几种,现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成,过滤,溶液呈无色:
②向①的沉淀物中加入足量稀硝酸,固体完全溶解,并有气泡产生;
③取少量②的溶液,滴入稀硫酸,有白色沉淀产生;
④另取①中过滤后的溶液加入足量AgNO3溶液,产生白色沉淀。
试根据上述实验事实,回答下列问题:
(1)写出原白色粉末中一定含有的物质的化学式
(2)写出原白色粉末中一定不含的物质的电离方程式
(3)写出下列各步变化的离子方程式:
②
④
根据反应8NH3 + 3Cl2 ="=" 6NH4Cl + N2 ,回答下列问题:
(1) 还原剂是(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为升。
(14分)过氧化氢俗名双氧水,医疗上利甩它有杀菌消毒作 用来清洗伤口。根据下列反应回答问题。
用来清洗伤口。根据下列反应回答问题。
A.
B.
C.
D .
.
(1)上述反应中, 仅体现氧化性的反应是(填代号,下同),
仅体现氧化性的反应是(填代号,下同), 既体现氧化性又体现还原性的反应是。
既体现氧化性又体现还原性的反应是。
(2)上述反应说明 的氧化性由强到弱的顺序是。
的氧化性由强到弱的顺序是。
(3)某强酸性反应体系中发生的一个氧化还原的离子反应,反应物和生成物共六种微粒: 已知该反应中
已知该反应中 只发生了如下过程:
只发生了如下过程: 。
。
①反应体系选择的酸是(填"序号")。
A.盐酸 B.浓硫酸 C .稀硫酸 D.醋酸
.稀硫酸 D.醋酸
②如果上述反应中有 6.72L(标准状况)气体生成,转移的电子为 mol.
(4) 有时可作为矿业废液消毒剂,有"绿色氧化剂"的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+
有时可作为矿业废液消毒剂,有"绿色氧化剂"的美称;如消除采矿业胶液中的氰化物(如KCN),经以下反应:KCN+ +
+ =A+
=A+ (化学方程式已配平),试指出生成物A的化学式为,并阐明
(化学方程式已配平),试指出生成物A的化学式为,并阐明 被称为绿色氧化剂的理由是
被称为绿色氧化剂的理由是
。